题目内容
原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关,下列说法中不正确的是
| A.由Al、Cu、稀H2SO4组成原电池,放电时SO42-向Al电极移动 |
| B.由Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3e-+4OH-===AlO2-+2H2O |
| C.由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Cu-2e-===Cu2+ |
| D.由Al、Cu、浓硝酸组成原电池作电源,用石墨电极来电解硝酸银溶液,当析出1 mol Ag时,消耗铜电极32 g |
C
解析试题分析:A.由Al、Cu、稀H2SO4组成原电池,由于Al活泼,所以Al作负极,Cu作正极,根据同种电荷相互排斥,异种电荷相互吸引的原则,放电时SO42-向正电荷较多的Al电极移动,正确;B.由Mg、Al、NaOH溶液组成原电池,负极是Al,其负极反应式为:Al-3e-+4OH-===AlO2-+2H2O,正确;C.由Fe、Cu、FeCl3溶液组成原电池,负极是Fe,其负极反应式为:Fe-2e-===Fe2+,错误;D.在电解过程中,整个闭合回路中电子转移数目相等,由Al、Cu、浓硝酸组成原电池作电源,由于Al在浓硝酸中会发生钝化,所以Cu是负极,用石墨电极来电解硝酸银溶液,当析出1 mol Ag时,转移电子1mol,因此负极材料Cu消耗铜电极32 g,正确。
考点:考查原电池、电解池的反应原理及应用的知识。

 全优点练单元计划系列答案
全优点练单元计划系列答案人体血液里Ca2+离子的浓度一般采用mg/mL来表示。加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定,使草酸转化成CO2逸出。
试回答:
(1)现需要80 mL 0.02 mol·L-1标准KMnO4溶液来进行滴定,则配制溶液时需要的玻璃仪器有烧杯、玻璃棒和______________________;配制时, KMnO4溶液应用强酸酸化,本实验选择________作酸化剂。若选择HNO3酸化,则结果可能________(填“偏大”“偏小”或“不变”)。
(2)草酸与KMnO4反应的离子方程式为______________________________________
(3)滴定时,根据现象___________________________________
即可确定反应达到终点。
(4)滴定的实验数据如下所示:
| 实验编号 | 待测血液的体积/mL | 滴入KMnO4溶液的体积/mL |
| 1 | 20.00 | 11.95 |
| 2 | 20.00 | 13.00 |
| 3 | 20.00 | 12.05 |
经过计算,血液样品中Ca2+离子的浓度为________mg/mL。
(5)滴定的方法有酸碱中和滴定、沉淀滴定、络合滴定等。沉淀滴定所用的指示剂本身就是一种沉淀剂。以AgNO3标准溶液测定Cl-为例:
终点前:Ag++Cl-=AgCl (白色)
终点时:2Ag++CrO42—=Ag2CrO4(砖红色)
这是因为AgCl溶解度比Ag2CrO4更________的缘故。
Ba(NO3)2可用于生产绿色烟花、绿色信号弹、炸药等。某生产BaCO3、BaSO4的化工厂生产中排出大量的钡泥[主要含有BaCO3、BaSO3、Ba(FeO2)2等],该厂利用钡泥制取Ba(NO3)2晶体(不含结晶水),其部分工艺流程如下:
已知: ①Fe3+和Fe2+以氢氧化物形式沉淀完全时,溶液的pH分别为3.2和9.7;
②Ksp(BaSO4)=1.1×10-10,Ksp(BaCO3)=5.1×10-9。
(1)该厂生产的BaCO3因含有少量BaSO4而不纯,提纯的方法是:将产品加入足量的饱和Na2CO3溶液中,充分搅拌,过滤,洗涤。用离子方程式说明提纯原理: 。
(2)酸溶时,Ba(FeO2)2与HNO3反应生成两种硝酸盐,化学方程式为 。
(3)该厂结合本厂实际,选用的X为 (填序号),中和I使溶液中的 (填离子符号)的浓度减小。
| A.BaCl2 | B.Ba(OH)2 | C.Ba(NO3)2 | D.BaCO3 |
(5)测定所得Ba(NO3)2晶体的纯度:准确称取m1g晶体溶于蒸馏水,加入足量的硫酸,充分反应后,过滤、洗涤、干燥,称量其质量为m2g,则该晶体纯度的计算表达式为 。(已知Ba(NO3)2、BaSO4的式量分别为261、233)
下列金属防腐的措施中,使用外加电流的阴极保护法的是
| A.水中的钢闸门连接电源的负极 | B.金属护拦表面涂漆 |
| C.枪炮表面涂上一层油 | D.地下钢管连接镁块 |
关于如图所示的原电池,下列说法正确的是 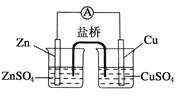
| A.锌电极发生还原反应,铜电极发生氧化反应 |
| B.盐桥中的阴离子向硫酸铜溶液中迁移 |
| C.电子从锌电极通过电流计流向铜电极 |
| D.铜电极上发生的电极反应为2H++2e-===H2↑ |
在100mLH2SO4和CuSO4的混合液中,用石墨做电极电解,两极上均收集到2.24L气体(标准状况下),则原混合液中,Cu2+的物质的量浓度为( )。
| A.1mol?L-1 | B.2mol?L-1 | C.3mol?L-1 | D.4mol?L-1 |
如图所示,下列叙述正确的是( ) 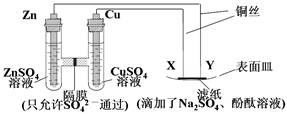
| A.隔膜左侧溶液的质量增加,隔膜右侧溶液的液面升高 |
| B.ZnSO4溶液与CuSO4溶液可以互换 |
| C.X与滤纸接触处有氧气生成 |
| D.Y与滤纸接触处有气泡产生,溶液逐渐变红 |
镁及其化合物一般无毒(或低毒)、无污染,且镁原电池放电时电压高而平稳。其中一种镁电池的反应为xMg+Mo3S4 MgxMo3S4,下列说法错误的是( )
MgxMo3S4,下列说法错误的是( )
| A.放电时Mg2+向正极迁移 |
| B.放电时正极反应为Mo3S4+2xe-===Mo3S42x- |
| C.充电时Mo3S4发生氧化反应 |
| D.充电时阴极反应为Mg2++2e-===Mg |
