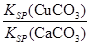题目内容
亚憐酸(H3PO3)是二元酸,与足量NaOH溶液反应生成Na2HPO3。
(1)PCl3水解可制取亚磷酸:PCl3+3H2O=H3PO3+_______。
(2)H3PO3溶液中存在电离平衡:H3PO3 H++H2PO3-。
H++H2PO3-。
①某温度下,0.10mol?L-1的 H3PO3溶液 pH =1.6,即溶液中c(H+) =2.5×10-2 mol?L-1。求该温度下上述电离平衡的平衡常数K,写出计算过程。(H3PO3的第二步电离忽略不计,结果保留两位有效数字。)
②根据H3PO3的性质可推测Na2HPO3稀溶液的pH________7 (填“>”、“=”或“<”)。
(3)亚磷酸具有强还原性,可使碘水褪色。该反应的化学方程式为_______。
(4)电解Na2HPO3溶液也可得到亚鱗酸,装置示意图如下:
①阴极的电极反应式为____________________________。
②产品室中反应的离子方程式为_____________________。
(15分)
(1)3HCl (2分)
(2)(5分)①解: H3PO3  H+ + H2PO3-
H+ + H2PO3-
起始浓度/mol?L-1 0.10 0 0
变化浓度/mol?L-1 2.5×10-2 2.5×10-2 2.5×10-2
平衡浓度/mol?L-1 7.5×10-2 2.5×10-2 2.5×10-2 (2分)
K= =
=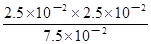 ≈8.3×10-3
≈8.3×10-3
答:该温度下上述电离平衡的平衡常数K约为8.3×10-3。 (3分)
(说明:各组分起始浓度、变化浓度、平衡浓度均正确得2分,平衡常数表达式、代入数据、结果各1分,带单位计算不扣分,其它合理写法也给分)
②> (2分)
(3)H3PO3+I2+H2O=H3PO4+2HI (3分)
(4)①2H++2e-=H2↑或2H2O+2e-=H2↑+2OH-(2分)
HPO32-+2H+=H3PO3 (2分)或HPO32-+H+= H2PO3-、H2PO3-+H+=H3PO3(各1分)
解析试题分析:(1)①由于c=n/V,各组分变化浓度之比等于系数之比,由此推断该反应体系中各组分的(起始、变化、平衡)浓度,则:
N2(g) + O2(g) 2NO(g)
2NO(g)
起始浓度(mol/L) 1.3 1.5 0
变化浓度(mol/L) 0.5 0.5 1
平衡浓度(mol/L) 0.8 1.0 1
根据平均反应速率的定义式,v(NO)=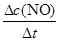 =
=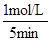 =0.2mol/(L?min)
=0.2mol/(L?min)
根据化学平衡常数的定义式,K=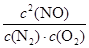 =
=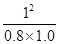 mol2/L2≈1.25
mol2/L2≈1.25
②混合气体的密度等于混合气体总质量除以容器体积,由于该反应各组分都是气体,所以混合气体总质量始终保持不变,容器体积始终为5L,因此混合气体密度始终保持不变,且密度不变不能说明达到平衡,故a错误;由于N2(g)+ O2(g) 2NO(g)的正反应是气体物质的量保持不变的反应,则混合气体总的物质的量始终不变,且容器内混合气体的压强始终不变不能说明达到平衡,故b错误;从反应开始达到平衡,反应物浓度逐渐减小,所以正反应速率逐渐减小,故c正确;单位时间内,N2和NO的消耗量之比就是正反应速率和逆反应速率之比,反应开始时,正反应速率最大、逆反应速率最小,此时N2和NO的消耗量之比最大,反应达到平衡时,正反应速率=逆反应速率,此时N2和NO的消耗量之比最小(为1/2),故d正确;
2NO(g)的正反应是气体物质的量保持不变的反应,则混合气体总的物质的量始终不变,且容器内混合气体的压强始终不变不能说明达到平衡,故b错误;从反应开始达到平衡,反应物浓度逐渐减小,所以正反应速率逐渐减小,故c正确;单位时间内,N2和NO的消耗量之比就是正反应速率和逆反应速率之比,反应开始时,正反应速率最大、逆反应速率最小,此时N2和NO的消耗量之比最大,反应达到平衡时,正反应速率=逆反应速率,此时N2和NO的消耗量之比最小(为1/2),故d正确;
(2)根据盖斯定律,已知的前一个热化学方程式减去后一个热化学方程式,可以得到:2H2(g) + 2NO(g)=N2(g) + 2H2O(l) ?△H = -752.1 kJ·mol-1;(3)读图,两条曲线先后达到平衡,说明T2>T1,即升高温度,平衡时c(NO)增大,由于升温平衡向吸热方向移动,c(NO)增大说明平衡向逆反应方向移动,则逆反应是吸热反应,所以正反应是放热反应,△H<0;画图要点:S1变为S2,即减小催化剂表面积,反应速率减小,单位时间内NO的变化浓度减小,则T1、S2的曲线位于T1、S1曲线的右边;催化剂不能使平衡移动,所以NO的平衡浓度与T1、S1曲线相同,只是达到平衡的时间比T1、S1曲线增大。
考点:考查化学反应原理,涉及求平均反应速率、化学平衡常数、化学平衡的建立、盖斯定律、热化学方程式、放热反应、吸热反应、画催化剂对反应速率和平衡移动的影响曲线。

 阅读快车系列答案
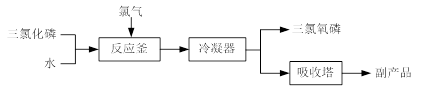
阅读快车系列答案(14分) CuCl是有机合成的重要催化剂,并用于颜料、防腐等工业。工业上由废铜料(含Fe、Al及其化合物、SiO2杂质),生产CuCl的工艺流程如下:
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Cu(OH)2 | 5.6 | 6.7 |
| Al(OH)3 | 3.8 | 4.7 |
已知:CuCl溶于NaCl的浓溶液可生成CuCl2-,CuCl2-的溶液用水稀释后可生成CuCl沉淀。
(1)煅烧的主要目的是: 。
(2)操作Ⅰ为调节溶液的PH值,范围为 ,加入的物质X可以是( )
A、CuO B、Cu(OH)2 C、NaOH 溶液 D、CaCO3
(3)滤渣Ⅱ的主要成分是 。
(4)往滤液Ⅱ中加入食盐并通入SO2可生成CuCl2-,请写出反应的离子方程式: 。
(5)在反应Ⅰ中,温度控制在70~80℃并使用浓NaCl溶液,主要目的是: 。
(6)常温下,已知CuOH的KSP为1.0×10-14,则Cu++H2O
 CuOH + H+的平衡常数为: 。
CuOH + H+的平衡常数为: 。 人体血液里Ca2+离子的浓度一般采用mg/mL来表示。加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定,使草酸转化成CO2逸出。
试回答:
(1)现需要80 mL 0.02 mol·L-1标准KMnO4溶液来进行滴定,则配制溶液时需要的玻璃仪器有烧杯、玻璃棒和______________________;配制时, KMnO4溶液应用强酸酸化,本实验选择________作酸化剂。若选择HNO3酸化,则结果可能________(填“偏大”“偏小”或“不变”)。
(2)草酸与KMnO4反应的离子方程式为______________________________________
(3)滴定时,根据现象___________________________________
即可确定反应达到终点。
(4)滴定的实验数据如下所示:
| 实验编号 | 待测血液的体积/mL | 滴入KMnO4溶液的体积/mL |
| 1 | 20.00 | 11.95 |
| 2 | 20.00 | 13.00 |
| 3 | 20.00 | 12.05 |
经过计算,血液样品中Ca2+离子的浓度为________mg/mL。
(5)滴定的方法有酸碱中和滴定、沉淀滴定、络合滴定等。沉淀滴定所用的指示剂本身就是一种沉淀剂。以AgNO3标准溶液测定Cl-为例:
终点前:Ag++Cl-=AgCl (白色)
终点时:2Ag++CrO42—=Ag2CrO4(砖红色)
这是因为AgCl溶解度比Ag2CrO4更________的缘故。
下列金属防腐的措施中,使用外加电流的阴极保护法的是
| A.水中的钢闸门连接电源的负极 | B.金属护拦表面涂漆 |
| C.枪炮表面涂上一层油 | D.地下钢管连接镁块 |
 Fe(OH)3+3HC1;△H>0。回答下列问题:
Fe(OH)3+3HC1;△H>0。回答下列问题: 6Cu+SO2↑,该反应的氧化剂是_____;验证反应产生的气体是SO2的方法是____________。
6Cu+SO2↑,该反应的氧化剂是_____;验证反应产生的气体是SO2的方法是____________。
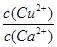 >
>