题目内容
5.三草酸合铁(Ⅲ)酸钾晶体(K3[Fe(C2O4)3]•XH2O)易溶于水,难溶于乙醇,可作为有机反应的催化剂.实验室可用铁屑为原料制备,相关反应的化学方程式为:Fe+H2SO4=FeSO4+H2↑
FeSO4+H2C2O4+2H2O=FeC2O4•2H2O↓+H2SO4
2FeC2O4•2H2O+H2O2+H2C2O4+3K2C2O4=2K3[Fe(C2O4)3]+6H2O
回答下列问题:
(1)铁屑与稀硫酸反应前,应用10%Na2CO3溶液浸泡几分钟,操作目的是除去铁屑表面的油污,浸泡后,倒掉碱液,用倾析法分离并洗涤铁屑,这种方法用到的玻璃仪器是玻璃棒、烧杯.
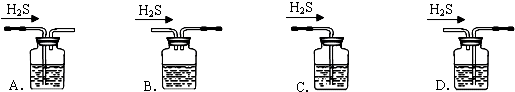
(2)铁屑中常含硫元素,因而在制备FeSO4时会产生有毒的H2S气体,该气体可用氢氧化钠溶液吸收.如图吸收装置正确的是A(选填序号);
(3)在将Fe2+氧化的过程中,需控制溶液温度不高于40℃,理由是防止H2O2分解;
(4)得到K3[Fe(C2O4)3]溶液后,再想获得其晶体,常加入B溶剂(填编号)
A.冰水 B.无水乙醇 C.四氯化碳 D.蒸馏水
(5)晶体中所含结晶水可通过重量分析法测定,主要步骤有:
①称量 ②置于烘箱中脱结晶水 ③冷却 ④称量 ⑤重复②~④步 ⑥计算
步骤⑤的操作其目的是确保晶体已全部失去结晶水;如何判断最后两次的称量质量之差小于0.1g.
(6)重量分析法测定时,步骤③未在干燥器中进行,那么测得的晶体中所含结晶水含量偏低(填“偏高”、“偏低”或“无影响”);
(7)三草酸合铁(Ⅲ)酸钾晶体用重量分析法测定时,4.91g的晶体经操作最终获得了4.37g无水物,则X=3.
分析 (1)CO32-水解生成OH-,溶液显碱性,酯在碱性条件下完全水解,用倾析法分离洗涤铁屑,用到的仪器烧杯中冲洗;
(2)气体吸收装置中既要吸收气体又能排出不反应的气体;
(3)温度高时氧化剂过氧化氢会分解;
(4)根据相似相溶原理分析;
(5)步骤⑤的是检验晶体中的结晶水是否已全部失去,称量至恒重,称量的结果两次称量不超过0.1g;
(6)步骤③未在干燥器中进行,会吸收空气中的水蒸气,测定晶体所含结晶水含量偏低;
(7)[K3[Fe(C2O4)3]•XH2O=K3[Fe(C2O4)3+XH2O,结合质量关系计算X;
解答 解:(1)CO32-水解生成OH-,溶液显碱性,酯在碱性条件下完全水解,所以可用纯碱溶液除油污,用倾析法分离洗涤铁屑,用到的仪器为在烧杯中国冲洗,主要玻璃仪器为玻璃棒、烧杯,
故答案为:除去铁屑表面的油污,倾析,玻璃棒、烧杯;
(2)A.该装置中硫化氢与氢氧化钠溶液接触面积大,从而使硫化氢吸收较完全,且该装置中气压较稳定,不产生安全问题,故A正确;
B.硫化氢与氢氧化钠接触面积较小,所以吸收不完全,故B错误;
C.没有排气装置,导致该装置内气压增大而产生安全事故,故C错误;
D.该装置中应遵循“长进短出”的原理,故D错误;
故选A;
(3)双氧水不稳定,温度高时,双氧水易分解,为防止双氧水分解,温度应低些,
故答案为:防止H2O2分解;
(4)根据相似相溶原理知,三草酸合铁酸钾在乙醇中溶解度小,所以可以用乙醇使三草酸合铁酸钾析出,
故答案为:B;
(5)步骤⑤的是检验晶体中的结晶水是否已全部失去,称量恒重的标准为两次质量不超过0.1g,说明结晶水全部失去达到恒重,
故答案为:确保晶体已全部失去结晶水,最后两次的称量质量之差小于0.1g;
(6)重量分析法测定时,步骤③未在干燥器中进行,会吸收空气中水蒸气为无水盐的质量那么测得的晶体中所含结晶水含量偏低,
故答案为:偏低;
(7)[K3[Fe(C2O4)3]•XH2O=K3[Fe(C2O4)3+XH2O
437 18X
4.91g 4.37g
X=3
故答案为:3;
点评 本题考查了实验制备物质的过程分析,实验基本操作方法,定量计算应用,掌握基础和实验操作是解题关键,题目难度中等.

 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案| A. | Na2CO3比NaHCO3易溶于水 | |
| B. | NaHCO3比Na2CO3稳定 | |
| C. | 石灰水能与NaHCO3反应,但不与Na2CO3反应 | |
| D. | 等质量的Na2CO3和NaHCO3与盐酸反应,消耗HCl的质量比为42:53 |
| A. | KClO3在反应中得到电子 | |
| B. | ClO2是氧化产物 | |
| C. | H2C2O4在反应中被氧化 | |
| D. | 1 molKClO3参加反应有1mol电子转移 |
| A. | 花生油、汽油都是“油”,花生油能与 NaOH 溶液和 KMnO4溶液反应,汽油与两者 都不反应 | |
| B. | 花生油是高分子化合物属混合物;汽油是小分子化合物属纯净物 | |
| C. | 乙醇、乙酸均能与 Na反应放 H2,但二者分子中所含官能团不同 | |
| D. | 乙烯和甲苯分子中所有原子都在同一个平面上 |
| A. | 电负性的大小顺序为Cl>S>P | |
| B. | 由于NO3-和SO3互为等电子体,所以可以推断NO3-的空间构型为平面三角形 | |
| C. | 根据晶格能的大小可以判断MgCl2的熔点比CaCl2高 | |
| D. | 液态HF的沸点比液态HCl的沸点高是因为氢氟键的键能比氢氯键的键能大 |
| A. | ⅠA族元素的金属性比ⅡA族元素的金属性强 | |
| B. | P、S、Cl得电子能力和最高价氧化物对应水化物的酸性均依次增强 | |
| C. | 同周期非金属氧化物对应的水化物的酸性从左到右依次增强 | |
| D. | 第三周期元素的离子半径从左到右逐渐减小 |
| A. | Fe3O4溶于足量稀HNO3:Fe3O4+8H+═Fe2++2Fe3++4H2O | |
| B. | NH4HCO3溶液与足量Ba(OH)2溶液混合:HCO3+Ba2++OH-═BaCO3↓+H2O | |
| C. | 向澄清石灰水中通入过量CO2:OH-+CO2═HCO3- | |
| D. | 将0.1mol/L的NH4Al(SO4)2溶液与0.3mol/L的Ba(OH)2溶液等体积混合:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ |
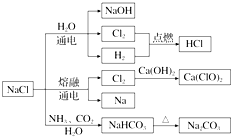
| A. | 25℃时,NaHCO3在水中的溶解度比Na2CO3的大 | |
| B. | 石灰乳与Cl2的反应中,Cl2既是氧化剂,又是还原剂 | |
| C. | 常温下干燥的Cl2能用钢瓶贮运,所以Cl2在任何条件下都不与铁反应 | |
| D. | 图示转化反应都是氧化还原反应 |