题目内容
17.如图中A~L分别表示反应中的一种常见物质,E、F、I在通常状况下是气体单质,其中E为有剌激性气味的气体,X、Y是常见的金属单质,参加反应的水以及生成的水在图中已略去.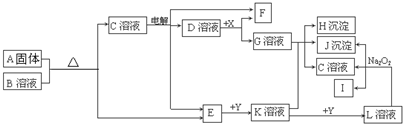
填写下列空白:
(1)E是Cl2;J是Fe(OH)3.(写化学式)
(2)写出C溶液电解的化学方程式2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2NaOH.
(3)写出G+K→H+J+C的离子方程式3AlO2-+Fe3++6H2O=3Al(OH)3↓+Fe(OH)3↓.
分析 E为有剌激性气味的气体单质,Y是常见的金属单质,E与Y反应生成K,K能与Y反应生成L,则Y为变价金属,E具有强氧化性,可以推断Y为Fe,E为Cl2,K为FeCl3,L为FeCl2,L的溶液中加入过氧化钠得到沉淀J为Fe(OH)3、气体单质I为O2、C为NaCl,电解C溶液生成E、F、D,D是溶液,所以F为H2、D为NaOH,D和金属X生成F和G,可判断X为Al,G为NaAlO2,K和G发生双水解得H为Al(OH)3,固体A与B反应生成C和E,应以为:NaClO+2HCl=NaCl+Cl2↑+H2O,据此答题.
解答 解:E为有剌激性气味的气体单质,Y是常见的金属单质,E与Y反应生成K,K能与Y反应生成L,则Y为变价金属,E具有强氧化性,可以推断Y为Fe,E为Cl2,K为FeCl3,L为FeCl2,L的溶液中加入过氧化钠得到沉淀J为Fe(OH)3、气体单质I为O2、C为NaCl,电解C溶液生成E、F、D,D是溶液,所以F为H2、D为NaOH,D和金属X生成F和G,可判断X为Al,G为NaAlO2,K和G发生双水解得H为Al(OH)3,固体A与B反应生成C和E,应以为:NaClO+2HCl=NaCl+Cl2↑+H2O.
(1)由上述分析可知,E是 Cl2,J是Fe(OH)3,故答案为:Cl2;Fe(OH)3;
(2)NaCl溶液电解的化学方程式:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2NaOH,故答案为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2NaOH;
(3)G+K→H+J+C的离子方程式:3AlO2-+Fe3++6H2O=3Al(OH)3↓+Fe(OH)3↓,故答案为:3AlO2-+Fe3++6H2O=3Al(OH)3↓+Fe(OH)3↓.
点评 本题考查无机物推断,难度中等,涉及钠、氯、铁等元素化合物性质,需要学生熟练掌握元素化合物知识,注意充分利用题目中特殊反应、反应信息及物质的性质等推断.

 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案| A. | Mg2+、NO3-、Cl-、Na+ | B. | K+、SO42-、HCO3-、Na+ | ||
| C. | NH4+、NO3-、Al3+、CH3COO- | D. | MnO4-、K+、SO42-、Na+ |
| A. | 增大 | B. | 减小 | C. | 不变 | D. | 无法判断 |
| A. | 溴苯和水 | B. | 乙酸乙酯和水 | C. | 溴乙烷和乙醇 | D. | 乙醇和水 |
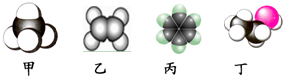
| A. | 甲是甲烷,甲烷能使酸性KMnO4溶液褪色 | |
| B. | 乙是乙烯,乙烯可与溴水发生取代反应使溴水褪色 | |
| C. | 丙是苯,苯在空气中燃烧时产生带有浓烟的火焰 | |
| D. | 丁是乙酸,一定条件下乙酸能跟乙醇发生取代反应 |
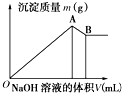
| A. | A点的沉淀是Mg(OH)2、Al(OH)3 | B. | B点的沉淀是Mg(OH)2、Al(OH)3 | ||
| C. | B点的沉淀是Al(OH)3 | D. | A点的沉淀是Mg(OH)2 |
 燃料电池具有广阔的发展前途,该电池有望取代传统电池,下图为某学生在实验室利用碱性氢氧燃料电池电解X溶液.
燃料电池具有广阔的发展前途,该电池有望取代传统电池,下图为某学生在实验室利用碱性氢氧燃料电池电解X溶液. .
.