题目内容
7.下列说法中不正确的是( )| A. | 电负性的大小顺序为Cl>S>P | |
| B. | 由于NO3-和SO3互为等电子体,所以可以推断NO3-的空间构型为平面三角形 | |
| C. | 根据晶格能的大小可以判断MgCl2的熔点比CaCl2高 | |
| D. | 液态HF的沸点比液态HCl的沸点高是因为氢氟键的键能比氢氯键的键能大 |
分析 A.同一周期元素,元素的电负性随着原子序数的增大而增大;
B.等电子体原子个数相等、价电子数相等,且结构相似;
C.离子晶体中,晶格能大小与离子半径成反比、与电荷成正比;
D.氢键的存在导致物质的沸点升高.
解答 解:A.同一周期元素,元素的电负性随着原子序数的增大而增大,这三种元素的电负性大小顺序是Cl>S>P,故A正确;
B.等电子体原子个数相等、价电子数相等,且结构相似,NO3-和SO3互为等电子体,NO3-的价层电子对个数=3+$\frac{1}{2}$×(5+1-3×2)=3,则该微粒是平面三角形结构,故B正确;
C.离子晶体中,晶格能大小与离子半径成反比、与电荷成正比,氯化镁和氯化钙中阴离子相同,阳离子不同,镁离子半径小于钙离子,所以氯化镁的晶格能大于氯化钙,则氯化镁的熔点高于氯化钙,故C正确;
D.HF中存在氢键、HCl中不存在氢键,氢键的存在导致HF的沸点高于HCl,故D错误;
故选D.
点评 本题考查较综合,涉及氢键、等电子体、晶格能、电负性等知识点,根据元素周期律、等电子体特点、晶格能的影响因素等知识点来分析解答,会利用价层电子对互斥理论确定微粒构型,为学习难点.

练习册系列答案
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案
相关题目
18.化学与生产、生活密切相关.下列叙述中,不正确的是( )
①制作计算机芯片的材料是Si晶体,漂白液的有效成分是NaClO
②二氧化碳和氮气均是造成温室效应的气体
③食醋可去除水垢,NH4Cl溶液可去除铁锈
④SO2和NO2都能使雨水的pH<5.6,造成酸雨
⑤硅胶可用作食品干燥剂
⑥向FeCl3溶液中不断加入NaOH溶液制备Fe(OH)3胶体
⑦用铜粉和硫粉混合加热制备CuS
⑧向铝盐溶液中不断滴入烧碱溶液制备Al(OH)3.
①制作计算机芯片的材料是Si晶体,漂白液的有效成分是NaClO
②二氧化碳和氮气均是造成温室效应的气体
③食醋可去除水垢,NH4Cl溶液可去除铁锈
④SO2和NO2都能使雨水的pH<5.6,造成酸雨
⑤硅胶可用作食品干燥剂
⑥向FeCl3溶液中不断加入NaOH溶液制备Fe(OH)3胶体
⑦用铜粉和硫粉混合加热制备CuS
⑧向铝盐溶液中不断滴入烧碱溶液制备Al(OH)3.
| A. | ②③⑦ | B. | ②⑥⑦⑧ | C. | ②③⑦⑧ | D. | ①②③⑥⑧ |
15.在恒温时,一固定容积的容器内通入1mol PCl5(g)发生如下反应:PCl5(g)?PCl3(g)+Cl2(g) 达到平衡时,再向容器内通入一定量的PCl5(g),重新达到平衡后,与第一次平衡时相比,PCl5的体积分数( )
| A. | 增大 | B. | 减小 | C. | 不变 | D. | 无法判断 |
2.盛放有较强腐蚀性的试剂瓶的标签上最应有的警示标志是( )
| A. |  | B. |  | C. |  | D. |  |
12.用分液漏斗可以分离的一组混合物是( )
| A. | 溴苯和水 | B. | 乙酸乙酯和水 | C. | 溴乙烷和乙醇 | D. | 乙醇和水 |
9.将一定量的镁铝合金放入一定量的盐酸中,合金恰好全部溶解,向所得溶液中滴加一定浓度的NaOH溶液,加入的NaOH溶液的体积(V)与沉淀质量(m)的关系如图所示.下面说法正确的是( )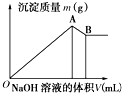

| A. | A点的沉淀是Mg(OH)2、Al(OH)3 | B. | B点的沉淀是Mg(OH)2、Al(OH)3 | ||
| C. | B点的沉淀是Al(OH)3 | D. | A点的沉淀是Mg(OH)2 |
10.对某些离子的检验及结论一定正确的是( )
| A. | 加入Ba(NO3)2溶液,生成白色沉淀,加稀盐酸沉淀不消失,则原溶液中一定有SO42- | |
| B. | 通入Cl2后,溶液变为黄色,加入淀粉后溶液变蓝,则原溶液中一定有I- | |
| C. | 加入碳酸钠溶液有白色沉淀生成,再加盐酸,沉淀消失,则原溶液中一定有Ba2+ | |
| D. | 加入NaOH溶液并加热,产生使湿润的蓝色石蕊试纸变红的气体,则原溶液一定有NH4+ |