题目内容
10.下列说法正确的是( )| A. | ⅠA族元素的金属性比ⅡA族元素的金属性强 | |
| B. | P、S、Cl得电子能力和最高价氧化物对应水化物的酸性均依次增强 | |
| C. | 同周期非金属氧化物对应的水化物的酸性从左到右依次增强 | |
| D. | 第三周期元素的离子半径从左到右逐渐减小 |
分析 A.应为同周期ⅠA族元素的金属性比ⅡA族元素的金属性强;
B.元素的非金属性越强,其得电子能力和最高价氧化物对应水化物的酸性越强;
C.应是同周期非金属元素最高价氧化物对应水化物的酸性酸性从左到右依次增强;
D.电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大.
解答 解:A.应为同周期ⅠA族元素的金属性比ⅡA族元素的金属性强,不是同周期则不一定,如金属性Ca>Na,故A错误;
B.元素的非金属性越强,其得电子能力和最高价氧化物对应水化物的酸性越强,P、S、Cl非金属性增强,则得电子能力和最高价氧化物对应水化物的酸性均依次增强,故B正确;
C.应是同周期非金属元素最高价氧化物对应水化物的酸性酸性从左到右依次增强,不是最高价不一定,弱硫酸为强酸,而HClO为弱酸,故C错误;
D.第三周期中阳离子比阴离子少一个电子层,电子层越多离子半径越大,阴离子半径大于阳离子半径,阳离子电子层结构相同,阴离子电子层结构相同,核电荷数越大离子半径越小,阳离子半径自左而右减小,阴离子半径自左而右减小,故D错误,
故选B.
点评 本题考查原子结构与元素周期律,注意对元素周期律的理解掌握,侧重于考查学生对基础知识的应用能力,难度不大.

练习册系列答案
相关题目
7.下列现象与胶体无关的是( )
| A. | 豆浆中加入石膏制豆腐 | |
| B. | 晚上,打开手电筒看到一条明亮的光路 | |
| C. | 用“血透”法治疗肾病患者 | |
| D. | 二氧化碳使澄清石灰水变浑浊 |
8.实验室有一瓶久置的白色K2SO3粉末,为确定其是否被氧化及其成分,下列结论错误的是( )
| A. | 将粉末溶于水,加入Ba(NO3)2,再加过量盐酸,有白色沉淀生成不能证明原粉末被氧化 | |
| B. | 粉末在空气中变质被氧化的方程式:2K2SO3+O2═2K2SO4 | |
| C. | 将粉末溶于水,加入氯化钡和过量的盐酸,有白色沉淀和气泡生成,证明原粉末是K2SO4和K2SO3的混合物 | |
| D. | 元素分析表明粉末中K和S元素的质量比为39:16,推测该粉末为纯净物 |
5.下列变化或过程中发生化学变化的是( )
| A. | 氮的固定 | |
| B. | 实验室中制取蒸馏水 | |
| C. | 石油裂解、煤的干馏、玉米制醇、蛋白质的变性和纳米银粒子的聚集 | |
| D. | 用铂丝蘸取NaCl溶液进行焰色反应 |
2.如图是四种常见有机物分子的比例模型示意图.下列说法正确的是( )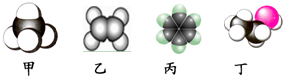

| A. | 甲是甲烷,甲烷能使酸性KMnO4溶液褪色 | |
| B. | 乙是乙烯,乙烯可与溴水发生取代反应使溴水褪色 | |
| C. | 丙是苯,苯在空气中燃烧时产生带有浓烟的火焰 | |
| D. | 丁是乙酸,一定条件下乙酸能跟乙醇发生取代反应 |
19.下列离子方程式正确的是( )
| A. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ | |
| B. | 硅酸钠溶液与醋酸溶液混合:SiO32-+2H+═H2SiO3↓ | |
| C. | 向NaAlO2溶液中通入过量CO2制Al(OH)3:CO2+AlO2-+2H2O═Al(OH)3↓+HCO3- | |
| D. | 向次氯酸钙溶液通入足量SO2:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO |
20.下列叙述中与物质化学性质无关的是( )
| A. | 用铂丝蘸取Na2CO3溶液在酒精灯焰上灼烧,观察到黄色火焰 | |
| B. | 明矾可用作净水剂 | |
| C. | 木条蘸取浓硫酸后变黑色 | |
| D. | 用水(滴加了酚酞试液)和氨气做喷泉实验 |