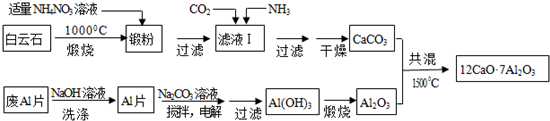
题目内容
3.ClO2是一种消毒杀菌效率高、二次污染小的水处理剂.实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4$\frac{\underline{\;△\;}}{\;}$2ClO2↑+K2SO4+2CO2↑+2H2O下列说法不正确的是( )| A. | KClO3在反应中得到电子 | |
| B. | ClO2是氧化产物 | |
| C. | H2C2O4在反应中被氧化 | |
| D. | 1 molKClO3参加反应有1mol电子转移 |
分析 2KClO3+H2C2O4+H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2ClO2↑+K2SO4+2CO2↑+2H2O(O均为-2价)中,Cl元素的化合价由+5价降低为+4价,C元素的化合价由+3价升高到+4价,以此来解答.
解答 解:A.Cl元素的化合价由+5价降低为+4价,所以氯酸钾得电子为氧化剂,故A正确;
B.Cl元素的化合价由+5价降低为+4价,所以氯酸钾对应的产物ClO2是还原产物,故B错误;
C.H2C2O4为还原剂,在反应中被氧化,故C正确;
D.1molKClO3参加反应有1mol×(5-4)=1mol电子转移,故D正确;
故选B.
点评 本题考查氧化还原反应,明确元素的化合价变化是解答本题的关键,并注意氧化剂、还原剂中元素的变化来解答,难度不大.

练习册系列答案
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案
相关题目
14.在无色透明酸性溶液中,能大量共存的离子组是( )
| A. | Mg2+、NO3-、Cl-、Na+ | B. | K+、SO42-、HCO3-、Na+ | ||
| C. | NH4+、NO3-、Al3+、CH3COO- | D. | MnO4-、K+、SO42-、Na+ |
18.化学与生产、生活密切相关.下列叙述中,不正确的是( )
①制作计算机芯片的材料是Si晶体,漂白液的有效成分是NaClO
②二氧化碳和氮气均是造成温室效应的气体
③食醋可去除水垢,NH4Cl溶液可去除铁锈
④SO2和NO2都能使雨水的pH<5.6,造成酸雨
⑤硅胶可用作食品干燥剂
⑥向FeCl3溶液中不断加入NaOH溶液制备Fe(OH)3胶体
⑦用铜粉和硫粉混合加热制备CuS
⑧向铝盐溶液中不断滴入烧碱溶液制备Al(OH)3.
①制作计算机芯片的材料是Si晶体,漂白液的有效成分是NaClO
②二氧化碳和氮气均是造成温室效应的气体
③食醋可去除水垢,NH4Cl溶液可去除铁锈
④SO2和NO2都能使雨水的pH<5.6,造成酸雨
⑤硅胶可用作食品干燥剂
⑥向FeCl3溶液中不断加入NaOH溶液制备Fe(OH)3胶体
⑦用铜粉和硫粉混合加热制备CuS
⑧向铝盐溶液中不断滴入烧碱溶液制备Al(OH)3.
| A. | ②③⑦ | B. | ②⑥⑦⑧ | C. | ②③⑦⑧ | D. | ①②③⑥⑧ |
8.实验室有一瓶久置的白色K2SO3粉末,为确定其是否被氧化及其成分,下列结论错误的是( )
| A. | 将粉末溶于水,加入Ba(NO3)2,再加过量盐酸,有白色沉淀生成不能证明原粉末被氧化 | |
| B. | 粉末在空气中变质被氧化的方程式:2K2SO3+O2═2K2SO4 | |
| C. | 将粉末溶于水,加入氯化钡和过量的盐酸,有白色沉淀和气泡生成,证明原粉末是K2SO4和K2SO3的混合物 | |
| D. | 元素分析表明粉末中K和S元素的质量比为39:16,推测该粉末为纯净物 |
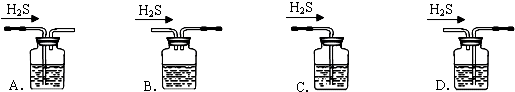
 燃料电池具有广阔的发展前途,该电池有望取代传统电池,下图为某学生在实验室利用碱性氢氧燃料电池电解X溶液.
燃料电池具有广阔的发展前途,该电池有望取代传统电池,下图为某学生在实验室利用碱性氢氧燃料电池电解X溶液.