题目内容
1.有200mL含有BaCl2 和Ba(NO3)2 的稀溶液,将其均分为两份,向其中一份缓慢加入足量的SO2,最终得到 amol沉淀(设硫元素全部转化为沉淀),此过程中的(总)反应离子方程式为3Ba2++2NO3-+2H2O+3SO2=3BaSO4+4H++2NO,原溶液中c(NO3- )=$\frac{20a}{3}$mol/L(用含a的数值表示);向另一份溶液中加入0.005mol SO3后溶液的pH的值为1.分析 向含有BaCl2 和Ba(NO3)2 的稀溶液缓慢加入足量的SO2,发生3Ba2++2NO3-+2H2O+3SO2=3BaSO4+4H++2NO,以此可计算c(NO3- ),溶液中加入0.005mol SO3,首先发生SO3+H2O=2H++SO42-,以此计算液的pH的值.
解答 解:向含有BaCl2 和Ba(NO3)2 的稀溶液缓慢加入足量的SO2,发生3Ba2++2NO3-+2H2O+3SO2=3BaSO4+4H++2NO,
n(NO3- )=$\frac{2}{3}$n(SO2)=$\frac{2}{3}$amol,
c(NO3- )=$\frac{2}{3}$×$\frac{amol}{0.1L}$=$\frac{20a}{3}$mol/L,
溶液中加入0.005mol SO3,首先发生SO3+H2O=2H++SO42-,n(H+)=2n(SO3)=0.01mol,
n(H+)=$\frac{0.01mol}{0.1L}$=0.1mol/L,pH=1,
故答案为:3Ba2++2NO3-+2H2O+3SO2=3BaSO4+4H++2NO;$\frac{20a}{3}$mol/L;1.
点评 本题考查化学方程式的计算,为高频考点,侧重于学生的分析、计算能力的考查,注意把握离子方程式的书写,为解答该题的关键,难度中等.

练习册系列答案
相关题目
11.将下列固体投入适量水中,再滴加酚酞,溶液不会变为红色的是( )
| A. | Na | B. | Na2O | C. | Na2CO3 | D. | NaCl |
12.化学与生产生活、环境保护、资源利用息息相关.下列叙述错误的是( )
| A. | 火力发电厂的燃煤中加适量石灰石,有利于环境保护 | |
| B. | 硅胶可做装食品的干燥剂 | |
| C. | 绿色食品是生产时不使用化肥农药,不含任何化学物质的食品 | |
| D. | 利用农作物秸秆制取乙醇 |
16.室温下,下列溶液中的粒子浓度关系正确的是( )
| A. | pH=4的NaHSO3溶液中:c(Na+ )>c(HSO3-)>c(H2SO3)>c(SO32-) | |
| B. | 0.01mol•L-1 的NaHCO3 溶液中存在如下平衡:HCO3-?H++CO3 2-,加水稀释溶液中的HCO3-、H+、CO3 2-浓度减少 | |
| C. | 浓度均为0.1mol•L-1 的CH3COOH、CH3COOK混合溶液中,2c(H+)+c(CH3COOH)=2c(OH-)+c(CH3COO-) | |
| D. | 若Ka(HA)=3.6×10-4,Ka(HB)=1.75×10-5,则等物质的量浓度的NaA、KB溶液相比:c(Na+ )-c(A-)=c(K+ )-c(B-) |
13.同温同压下,由C、H、O组成的有机物X的蒸汽相对氢气的密度为51,X中氧元素的质量分数为31.4%,则能在酸性条件下发生水解反应的X的同分异构体有(不考虑立体异构)( )
| A. | 7种 | B. | 8种 | C. | 9种 | D. | 10种 |
10.设nA为阿伏伽德罗常数的数值,下列说法正确的是( )
| A. | 标准状况下,2.24L苯含有的分子数为0.1nA | |
| B. | 25℃时,PH=13的Ba(OH)2的溶液中含有OH-的数目为0.2nA | |
| C. | 1L0.1mol•L-1Al2(SO4 )3的溶液Al3+的数目为0.2nA | |
| D. | 1.5molNO2与足量H2O反应,转移的电子数为nA |
13.能用OH-+H+═H2O 这个离子方程式表示的化学反应的是( )
| A. | 氢氧化铝和硝酸溶液反应 | B. | Fe(OH)3溶液和硫酸反应 | ||
| C. | 氢氧化钡溶液和稀硫酸 | D. | KOH溶液和稀硝酸反应 |
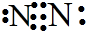 和结构式N≡N.
和结构式N≡N.