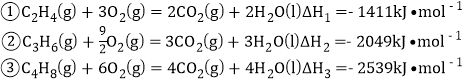题目内容
【题目】某温度下,在容积为1L的密闭容器中充入![]() 和
和![]() 发生
发生![]() 测得
测得![]() 的物质的量随时间的变化如图所示,(已知,此温度下,该反应的平衡常数
的物质的量随时间的变化如图所示,(已知,此温度下,该反应的平衡常数![]() )下列说法正确的是 ( )
)下列说法正确的是 ( )
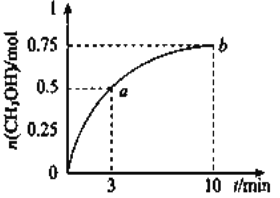
A. ![]()
B. 点b所对应的状态为化学平衡状态
C. ![]() 的生成速率,点a低于点b
的生成速率,点a低于点b
D. 欲增大平衡状态时![]() ,可保持其他条件不变,升高温度
,可保持其他条件不变,升高温度
【答案】B
【解析】
据定义计算反应速率,并利用不同物质表示的反应速率之间的关系进行换算;据可逆反应进行过程中正逆反应速率的变化,比较有关速率的大小;利用Qc与K的关系判断是否化学平衡状态;用平衡移动原理判断平衡移动方向。
A项:0~10min,n(CH3OH)增加0.75mol,v(CH3OH)=0.75mol/(1L×10min)=0.075mol·L-1·min-1,则v(H2)=0.075mol/(1L×10min)×3=0.225mol·L-1·min-1,A项错误;
B项:据图中数据,点b所在状态有0.25molCO2、1.0molH2、0.75molCH3OH、0.75molH2O(g),将它们的浓度代入Qc表达式,得Qc=2.25=K,为化学平衡状态,B项正确;
C项:从起始到平衡过程中,![]() 的生成速率(正反应速率)逐渐减小,即正反应速率点a高于点b,C项错误;
的生成速率(正反应速率)逐渐减小,即正反应速率点a高于点b,C项错误;
D项:欲使平衡状态时![]() 增大,即使平衡右移。因ΔH<0,可保持其他条件不变降低温度,D项错误。
增大,即使平衡右移。因ΔH<0,可保持其他条件不变降低温度,D项错误。
本题选B。

【题目】在人类文明的历程中,改变世界的事物很多,其中铁、硝酸钾、青霉素、氨、乙醇、二氧化碳、聚乙烯、二氧化硅等17种“分子”改变过人类的世界。
(1)铁原子在基态时,价电子(外围电子)排布式为______________________________。
(2)硝酸钾中![]() 的空间构型为________,写出与
的空间构型为________,写出与![]() 互为等电子体的一种非极性分子化学式__________________________________________________________________。
互为等电子体的一种非极性分子化学式__________________________________________________________________。
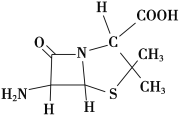
(3)6氨基青霉烷酸的结构如图所示,其中采用sp3杂化的原子有____________。
(4)下列说法正确的有________(填字母序号)。
a.乙醇分子间可形成氢键,导致其沸点比氯乙烷高
b.钨的配合物离子[W(CO)5OH]-能催化固定CO2,该配离子中钨显-1价
c.聚乙烯(CH2CH2)分子中有5n个σ键
d.由下表中数据可确定在反应Si(s)+O2(g)===SiO2(s)中,每生成60 g SiO2放出的能量为(2c-a-b) kJ
化学键 | Si—Si | O===O | Si—O |
键能(kJ·mol-1) | a | b | c |
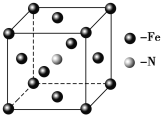
(5)铁和氨气在640 ℃可发生置换反应,产物之一的晶胞结构如图所示,写出该反应的化学方程式______________________________________。
 .
.