题目内容
18.溴主要以Br-形式存在于海水中,海水呈弱碱性.工业上制备Br2的操作步骤为:①一定条件下,将C12通入浓缩的海水中,生成Br2
②利用热空气将Br2吹出,并用浓Na2CO3溶液吸收,生成NaBr、NaBrO3等
③用硫酸酸化步骤②得到的混合物
完成下列填空:
(1)C12氧化Br-应在酸性条件下进行,目的是为了避免生成的溴与碱发生反应,实验室制取C12尾气吸收的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O.
(2)Br2可用热空气吹出,其原因是溴易挥发.
(3)写出步骤③所发生的化学反应方程式3H2SO4+5NaBr+NaBrO3=3Na2SO4+3Br2+3H2O.用硫酸而不用盐酸酸化的原因可能是用盐酸酸化,则盐酸被NaBrO3氧化.步骤②的产品有时运输到目的地后再酸化,主要是因为Br2易挥发,对大气有污染;.
(4)为了除去工业Br2中微量的C12,可向工业Br2中c.
a.通入HBr
b.加入Na2CO3溶液
c.加入NaBr溶液
d.加入Na2SO3溶液.
分析 (1)Cl2氧化Br-生成溴单质,溴单质和碱发生氧化还原反应,溴易挥发,且有毒;
(2)溴利用易挥发的物质性质分析,热空气吹出溴蒸气;
(3)用硫酸酸化步骤②得到的混合物NaBr、NaBrO3,发生氧化还原反应生成硫酸钠、溴单质、水;盐酸具有还原性能被溴酸钠氧化,并结合溴挥发来分析;
(4)利用NaBr溶液与Cl2反应,然后分液可除去Cl2.
解答 解:(1)一定条件下,将A通入浓缩的海水中,生成Br2,通入的A为Cl2,Cl2氧化Br-应在酸性溶液中发生氧化还原反应,目的是为了避免生成的溴与碱发生反应,C12尾气吸收的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:生成的溴与碱发生反应,Cl2+2OH-=Cl-+ClO-+H2O;
(2)因溴易挥发,则可用热空气吹出,故答案为:溴易挥发;
(3)发生氧化还原反应生成硫酸钠、溴单质、水,该反应为3H2SO4+5NaBr+NaBrO3=3Na2SO4+3Br2+3H2O;盐酸能被溴酸钠氧化,则不能利用盐酸酸化,且溴挥发,对大气造成污染,所以有时运输到目的地后再酸化,
故答案为:3H2SO4+5NaBr+NaBrO3=3Na2SO4+3Br2+3H2O;用盐酸酸化,则盐酸被NaBrO3氧化;Br2易挥发,对大气有污染;
(4)利用NaBr溶液与Cl2反应,然后分液可除去Cl2,只有c符合,其它选项会引入新的杂质,故答案为:c.
点评 本题考查了海水提溴的生产工艺流程分析判断,物质性质是解题关键,题目较简单.

练习册系列答案
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案
相关题目
8. 钠-氯化镍电池是一种高能电池,其结构如图所示,用β″-Al2O3陶瓷管为载体,熔融NaAlCl4为电解质.其反应式为:Ni+2NaCl?充电放电2Na+NiCl2;该电池本身具有过充电和过放电保护机制.下列关于该电池的叙述错误的是( )
钠-氯化镍电池是一种高能电池,其结构如图所示,用β″-Al2O3陶瓷管为载体,熔融NaAlCl4为电解质.其反应式为:Ni+2NaCl?充电放电2Na+NiCl2;该电池本身具有过充电和过放电保护机制.下列关于该电池的叙述错误的是( )
 钠-氯化镍电池是一种高能电池,其结构如图所示,用β″-Al2O3陶瓷管为载体,熔融NaAlCl4为电解质.其反应式为:Ni+2NaCl?充电放电2Na+NiCl2;该电池本身具有过充电和过放电保护机制.下列关于该电池的叙述错误的是( )
钠-氯化镍电池是一种高能电池,其结构如图所示,用β″-Al2O3陶瓷管为载体,熔融NaAlCl4为电解质.其反应式为:Ni+2NaCl?充电放电2Na+NiCl2;该电池本身具有过充电和过放电保护机制.下列关于该电池的叙述错误的是( )| A. | 该电池在常温下不能正常工作 | |
| B. | 熔融NaAlCl4不参与正常电极反应 | |
| C. | 正常充电的阴极反应;NaCl+e-=Na+Cl- | |
| D. | 过放电时正极反应:AlCl−4-3e-=4Cl-+Al |
6.下列装置或操作能达到实验目的是( )
| A. | 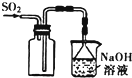 用图所示装置收集SO2气体 | |
| B. | 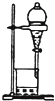 用图所示装置萃取碘水中的碘 | |
| C. | 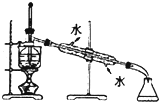 用图所示装置进行石油的分馏 | |
| D. | 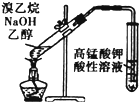 用图所示装置检验溴乙烷与NaOH乙醇溶液共热产生的乙烯 |
3.某二元酸H2A在水溶液中以下列方式进行电离:H2A═H++HA-、HA-?H++A2-下列说法正确的是( )
| A. | 室温时,NaHA溶液pH<7,是由于HA-的电离程度大于其水解程度 | |
| B. | 在0.1 mol/L的Na2A溶液中:c(A2-)+c(HA-)+c(H2A)=0.1 mol/L | |
| C. | 在0.1 mol/L的NaHA溶液中,一定有:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) | |
| D. | 向两份等体积NaHA、Na2A的浓度比为1:1的混合溶液中分别加入适当浓度的盐酸与氢氧化钠,其pH随加入酸、碱量的变化图象为: |
10.用眠表示阿伏加德罗常数的值.下列叙述中正确的是( )
| A. | 标准状况下,2.24 LH2O中含有的原子总数为3NA | |
| B. | 等物质的量的Na2O和Na2O2中含有的阴离子总数不同 | |
| C. | Imol甲基(-14C1H3)所含的中子数和电子数分别为8NA、9NA | |
| D. | t℃时,MgCO3的Ksp=4×10-6,则饱和溶液中含Mg2+数目为2×l0-3NA |
8. 甲、乙、丙三种物质均含有铝元素,在溶液中的转化关系如图所示.下列说法正确的是( )
甲、乙、丙三种物质均含有铝元素,在溶液中的转化关系如图所示.下列说法正确的是( )
 甲、乙、丙三种物质均含有铝元素,在溶液中的转化关系如图所示.下列说法正确的是( )
甲、乙、丙三种物质均含有铝元素,在溶液中的转化关系如图所示.下列说法正确的是( )| A. | 若甲是Al,丙是Al(NO3)3,则乙一定是NaAlO2 | |
| B. | 若甲是Al2O3,丙是NaAlO2,则乙一定是Al(NO3)3 | |
| C. | 若甲是Al(NO3)3,丙是NaAlO2,则乙一定是Al(OH)3 | |
| D. | 若甲是Al(OH)3,丙是Al(NO3)3,则乙一定是NaAlO2 |
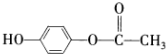
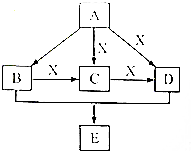 A、B、C、D、E均为常见的有机物,X是一种无机物,常温下A是气体,生活中的两种常见调味品中分别含有B和D,E是一种常见的有机溶剂和化工原料.《必修2》中介绍从A合成E的几种可能的合成路线,其转化关系可以用如图表示(图中部分产物及条件已略去).回答下列问题:
A、B、C、D、E均为常见的有机物,X是一种无机物,常温下A是气体,生活中的两种常见调味品中分别含有B和D,E是一种常见的有机溶剂和化工原料.《必修2》中介绍从A合成E的几种可能的合成路线,其转化关系可以用如图表示(图中部分产物及条件已略去).回答下列问题: ,工业上大量获得A的方法是石油裂解.
,工业上大量获得A的方法是石油裂解. CH3COOCH2CH3+H2O;
CH3COOCH2CH3+H2O; )是一种重要的化工原料,其合成路线如下:
)是一种重要的化工原料,其合成路线如下:


 .
. (其中任一种).(写出一种即可).
(其中任一种).(写出一种即可).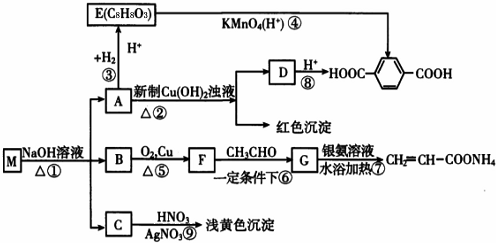
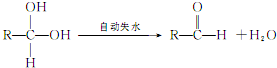
 ;
; ;
; ;
;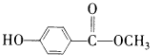 ,
, ?
?