题目内容
13.下表为元素周期表的一部分,表中列出10种元素在周期表中的位置,按要求用化学用语回答下列各题.| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑧ | ⑩ | ||||||
| 3 | ① | ③ | ⑤ | ⑥ | ⑦ | ⑨ | ||
| 4 | ② | ④ |
(2)元素④的离子结构示意图为
 ;元素⑥的气态氢化物分子式SiH4.
;元素⑥的气态氢化物分子式SiH4.(3)上述10种元素中,其最高价氧化物对应水化物酸性最强的是:HClO4.
(4)⑧①⑥元素的原子半径由小到大的顺序为r(F)<r(Si)<r(Na);⑦⑧⑨元素形成气态化合物的稳定性由强至弱的顺序为HF>HCl>PH3.
(5)①和⑤两元素最高价氧化物对应的水化物相互反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O.
分析 由元素在周期表中位置,可知①为Na、②为K、③为Mg、④为Ca、⑤为Al、⑥为Si、⑦为P、⑧为F、⑨为Cl、⑩为Ne.
(1)所有元素中稀有气体化学性质最不活泼;
(2)Ca2+离子质子数为20,核外电子数为18,有3个电子层,各层电子数为2、8、8;元素⑥的气态氢化物为SiH4;
(3)F元素没有最高价含氧酸,其它元素中Cl元素非金属性最强,故高氯酸酸性最强;
(4)同周期自左而右原子半径减小、同主族自上而下原子半径增大;非金属性越强,氢化物越稳定;
(5)①和⑤两元素最高价氧化物对应的水化物分别为NaOH、Al(OH)3,二者反应生成偏铝酸钠与水.
解答 解:由元素在周期表中位置,可知①为Na、②为K、③为Mg、④为Ca、⑤为Al、⑥为Si、⑦为P、⑧为F、⑨为Cl、⑩为Ne.
(1)所有元素中稀有气体化学性质最不活泼,故Ne化学性质最不活泼,故答案为:Ne;
(2)Ca2+离子质子数为20,核外电子数为18,有3个电子层,各层电子数为2、8、8,离子结构示意图为 ;元素⑥的气态氢化物为SiH4,
;元素⑥的气态氢化物为SiH4,
故答案为: ;SiH4;
;SiH4;
(3)F元素没有最高价含氧酸,其它元素中Cl元素非金属性最强,故HClO4酸性最强,故答案为:HClO4;
(4)同周期自左而右原子半径减小、同主族自上而下原子半径增大,故原子半径:r(F)<r(Si)<r(Na);非金属性F>Cl>P,故氢化物稳定性:HF>HCl>PH3,
故答案为:r(F)<r(Si)<r(Na);HF>HCl>PH3;
(5)①和⑤两元素最高价氧化物对应的水化物分别为NaOH、Al(OH)3,二者反应生成偏铝酸钠与水,反应离子方程式为Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O.
点评 本题考查元素周期表与元素周期律综合应用,难度不大,注意对元素周期表与元素周期律掌握,有利于基础知识的巩固.

 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案| A. | 硫酸与氢氧化钡在溶液中反应:Ba2++SO42-═BaSO4↓ | |
| B. | 在NaOH溶液中加入醋酸溶液:H++OH-═H2O | |
| C. | 用小苏打治疗胃酸过多:HCO3-+H+═CO2↑+H2O | |
| D. | 向FeI2溶液中通入过量Cl2:2Fe2++Cl2═2Fe3++2Cl- |
| A. |  与 与 互为同系物 互为同系物 | B. | 乙醇和乙醚互为同分异构体 | ||
| C. | 可用溴水来区分苯和苯的同系物 | D. | 乙醇、乙二醇、丙三醇互为同系物 |
| A. | 所含质子数为(A-n) | B. | 所含中子数为(A-Z) | ||
| C. | 所含电子数为(Z+n) | D. | 中子数-电子数=A-2Z-n |
| A. | ①②③④ | B. | ④③①② | C. | ④③②① | D. | ②①④③ |
①苯不能使溴水褪色
②苯不能使酸性高锰酸钾溶液褪色
③苯在一定条件下既能发生取代反应,又能发生加成反应
④经测定,邻二甲苯只有一种结构
⑤经测定,苯环上碳碳键的键长相等,都是1.40×10-10m.
| A. | ①② | B. | ①②③ | C. | ①②③⑤ | D. | ①②④⑤ |
 空气中CO2含量偏高会产生温室效应,也会对人体健康造成影响;CO2的用途广泛,合理使用则可缓解由CO2累积所产生的温室效应,实现CO2的良性循环.
空气中CO2含量偏高会产生温室效应,也会对人体健康造成影响;CO2的用途广泛,合理使用则可缓解由CO2累积所产生的温室效应,实现CO2的良性循环.(1)一定条件下CO2可制得Na2CO3、NaHCO3等.
①等物质的量浓度的Na2CO3、NaHCO3溶液,碱性前者>后者(填“>”“<”或“=”).
②有下列五种物质的量浓度均为0.1mol/L的电解质溶液,将其稀释相同倍数时,pH变化最大的是E(填字母编号).
A.Na2CO3B.NaHCO3 C.NaAlO2 D.CH3COONa E.NaOH
(2)已知反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H=a kJ/mol,测得在不同温度下,
该反应的平衡常数K随温度的变化如下:
| 温度(℃) | 300 | 500 | 700 |
| K | 3.00 | 3.47 | 4.40 |
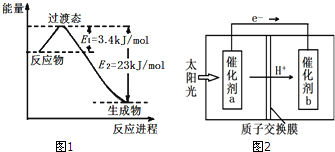
(3)目前工业上可以用CO2和H2在230℃、催化剂条件下反应生成甲醇蒸汽和水蒸气.图1为恒压容器中0.5mol CO2和1.5mol H2反应转化率达80%时的能量变化示意图.则该反应的热化学方程式为:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=-49 kJ/mol.
(4)人工光合作用能够借助太阳能,用CO2和H2O制备化学原料.图2是制备HCOOH的示意图,根据要求回答问题:
①催化剂b表面的电极反应式为CO2+2e-+2H+=HCOOH.
②经测定,若每分钟通过质子交换膜的H+的物质的量为40mol,则每小时可产生O219.2Kg.
| A. | 7.8g Na2O2中含有的阴离子数目为0.1NA | |
| B. | 常温下,34gH2O2中H-O键数目为2NA | |
| C. | 1.00mol NaCl晶体中含有NA个NaCl分子 | |
| D. | 在20g D216O中含有10 NA个电子 |
 有止血作用,特别对内脏的止血效果较好.
有止血作用,特别对内脏的止血效果较好. .
. .
.