题目内容
3.设NA是阿伏加德罗常数的数值.下列说法不正确的是( )| A. | 7.8g Na2O2中含有的阴离子数目为0.1NA | |
| B. | 常温下,34gH2O2中H-O键数目为2NA | |
| C. | 1.00mol NaCl晶体中含有NA个NaCl分子 | |
| D. | 在20g D216O中含有10 NA个电子 |
分析 A、过氧化钠中的阴离子为 过氧根离子,0.1mol过氧化钠中含有0.1mol阴离子;
B、双氧水分子中存在两个氢氧键,34g双氧水的物质的量为1mol,含有2mol氢氧键;
C、氯化钠为离子晶体,不存在分子;
D、重水的摩尔质量为20g/mol,根据m=$\frac{m}{M}$计算重水的物质的量,再根据N=nNA计算电子数目.
解答 解:A、7.8g过氧化钠的物质的量为0.1mol,0.1mol过氧化钠中含有0.1mol过氧根离子,含有的阴离子数目为0.1NA,故A正确;
B、34g双氧水中的物质的量为1mol,1mol双氧水中含有2mol氧氢键,含有的H-O键数目为2NA,故B正确;
C、氯化钠为离子晶体,不存在氯化钠分子,故C错误;
D、20g重水中含有电子数为$\frac{20g}{20g/mol}$×10×nAmol-1=10NA,故D正确.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
13.下表为元素周期表的一部分,表中列出10种元素在周期表中的位置,按要求用化学用语回答下列各题.
(1)这10种元素中,化学性质最不活泼的元素是Ne,
(2)元素④的离子结构示意图为 ;元素⑥的气态氢化物分子式SiH4.
;元素⑥的气态氢化物分子式SiH4.
(3)上述10种元素中,其最高价氧化物对应水化物酸性最强的是:HClO4.
(4)⑧①⑥元素的原子半径由小到大的顺序为r(F)<r(Si)<r(Na);⑦⑧⑨元素形成气态化合物的稳定性由强至弱的顺序为HF>HCl>PH3.
(5)①和⑤两元素最高价氧化物对应的水化物相互反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑧ | ⑩ | ||||||
| 3 | ① | ③ | ⑤ | ⑥ | ⑦ | ⑨ | ||
| 4 | ② | ④ |
(2)元素④的离子结构示意图为
 ;元素⑥的气态氢化物分子式SiH4.
;元素⑥的气态氢化物分子式SiH4.(3)上述10种元素中,其最高价氧化物对应水化物酸性最强的是:HClO4.
(4)⑧①⑥元素的原子半径由小到大的顺序为r(F)<r(Si)<r(Na);⑦⑧⑨元素形成气态化合物的稳定性由强至弱的顺序为HF>HCl>PH3.
(5)①和⑤两元素最高价氧化物对应的水化物相互反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O.
14.下列关于甲烷的叙述中错误的是( )
| A. | 甲烷分子具有正四面体结构,两个碳氢键之间的夹角为109°28′ | |
| B. | 甲烷分子中两个氢原子被氯取代后,可形成两种不同结构的分子 | |
| C. | 甲烷是重要的化工原料,其分解产物可用于合成氨和橡胶工业 | |
| D. | “抽”出坑道中的甲烷,既可用作清洁燃料,又可防止爆炸 |
11.将1mol 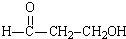 加入到足量的酸性KMnO4溶液中,充分反应后生成丙二酸,锰元素在生成物中为+2价,则消耗KMnO4的物质的量是( )
加入到足量的酸性KMnO4溶液中,充分反应后生成丙二酸,锰元素在生成物中为+2价,则消耗KMnO4的物质的量是( )
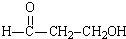 加入到足量的酸性KMnO4溶液中,充分反应后生成丙二酸,锰元素在生成物中为+2价,则消耗KMnO4的物质的量是( )
加入到足量的酸性KMnO4溶液中,充分反应后生成丙二酸,锰元素在生成物中为+2价,则消耗KMnO4的物质的量是( )| A. | 0.4mol | B. | 0.6mol | C. | 0.8mol | D. | 1.2mol |
18.下列粒子的结构示意图中,表示钠离子( )
| A. | 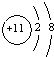 | B. | 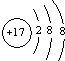 | C. | 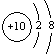 | D. | 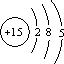 |
8.下列分子中所有原子都处于同一平面上的是( )
| A. | CH4、丙烯、丙炔 | B. | 乙烯、乙炔、苯 | ||
| C. | 1,3-丁二烯、C6H5-CH3、环己烷 | D. | 丙烯、乙炔、CH3CH3 |
15.在Na2CO3和HCl反应的下列各组实验中,反应速率最快的一组是( )
| 组号 | 温度(℃) | Na2CO3浓度(mol/L) | HCl浓度(mol/L) |
| A | 0 | 0.1 | 0.1 |
| B | 20 | 0.1 | 0.1 |
| C | 40 | 0.1 | 0.2 |
| D | 40 | 0.2 | 0.2 |
| A. | A | B. | B | C. | C | D. | D |
12.最近医学界通过用放射性15C跟踪标记C60,发现一种C60的羧酸衍生物在特定条件下可通过断裂DNA杀死细胞,从而抑制艾滋病(AIDS),则有关15C的叙述正确的是( )
| A. | 与C60中普通碳原子的化学性质不同 | |
| B. | 与16O的中子数相同 | |
| C. | 与12C互为同位素 | |
| D. | 是足球烯的同素异形体 |
13.下列离子方程式,正确的是( )
| A. | 过氧化钠与水反应:2O22-+2H2O═4OH-+O2↑ | |
| B. | 澄清石灰水中通入过量二氧化碳:OH-+CO2═HCO3- | |
| C. | 往FeCl3溶液中加入Cu粉:2Fe3++3Cu=2Fe+3Cu2+ | |
| D. | CaCO3溶于稀盐酸中:CO32-+2H+═CO2↑+H2O |