题目内容
【题目】在一定温度下,在1L密闭容器中加a mol SO2和b mol O2,反应达到平衡时有c mol SO2发生了反应,试填下列空白:
(1)生成 mol SO3;
(2)O2的转化率为 ;
(3)平衡时容器内气体的总物质的量为 ;
(4)达到平衡时,c(SO2)= , c(O2)= ,c(SO3)= 。
【答案】
(1)c
(2)(50c/b)%
(3)a+b-c/2 mol
(4)a-c b-0.5c c
【解析】
试题分析:依据化学平衡三段式列式计算
2SO2+O2![]() 2SO3
2SO3
起始量(mol) a b 0
变化量(mol) c 0.5c c
平衡量(mol) a-c b-0.5c c
(1)计算可知,反应生成三氧化硫物质的量为cmol;故答案为:c;
(2)O2的转化率=![]() ×100%=
×100%=![]() %。故答案为:
%。故答案为:![]() %;
%;
(3)平衡时容器内气体总物质的量=a-c+b-0.5c+c=(a+b-![]() )mol;故答案为:(a+b-
)mol;故答案为:(a+b-![]() )mol;
)mol;
(4)达到平衡时,c(SO2)= ![]() =a-c mol/L,同理c(O2)=b-0.5c mol/L,c(SO3)=c mol/L。
=a-c mol/L,同理c(O2)=b-0.5c mol/L,c(SO3)=c mol/L。

【题目】通常人们把拆开1 mol某化学键所吸收的能量或形成1 mol某化学键所释放的能量看作该化学键的键能,键能的大小可用于估算化学反应的反应热(ΔH),已知
化学健 | H-H | Cl-Cl | H-Cl |
键能 | 436 kJ/mol | 243 kJ/mol | 431 kJ/mol |
化学健 | H-H | Cl-Cl | H-Cl |
键能 | 436 kJ/mol | 243 kJ/mol | 431 kJ/mol |
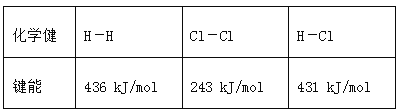
则下列热化学方程式不正确的是( )
A.![]() H2(g)+
H2(g)+ ![]() Cl2(g)===HCl(g) ΔH=+91.5 kJ·mol-1
Cl2(g)===HCl(g) ΔH=+91.5 kJ·mol-1
B.H2(g)+Cl2(g)===2HCl(g) ΔH=-183 kJ·mol-1
C.2HCl(g)===H2(g)+Cl2(g) ΔH=+183 kJ·mol-1
D.![]() H2(g)+
H2(g)+![]() Cl2(g)===HCl(g) ΔH=-91.5 kJ·mol-1
Cl2(g)===HCl(g) ΔH=-91.5 kJ·mol-1
【题目】有A、B、C、D、E五种短周期元素,其元素特征信息如下表,回答下列问题:
元素编号 | 元素特征信息 |
A | 其单质是密度最小的物质 |
B | 阴离子带两个单位负电荷,单质是空气的主要成分之一 |
C | 其阳离子与B的阴离子有相同的电子层结构,且与B可以形成两种离子化合物 |
D | 其氢氧化物和氧化物都有两性,与C同周期 |
E | 与C同周期,原子半径在该周期最小 |
(1)写出下列元素的名称:C________,E________;元素E在元素周期表中的位置是__________。
(2)写出A、B、C形成的化合物M的电子式________;B和C的离子中,半径较小的是______(填离子符号 );五种原子中半径最大的是________(填元素符号 )。五种元素最高价氧化物的水化物酸性最强的是(以上填化学式)________________________________。
(3)实验测得DE3在熔融状态下不导电,则DE3中含有的化学键类型为________。
(4)D单质与M的水溶液反应的离子方程式:________。