题目内容
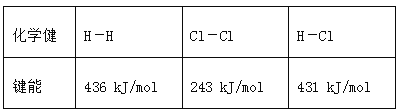
【题目】通常人们把拆开1 mol某化学键所吸收的能量或形成1 mol某化学键所释放的能量看作该化学键的键能,键能的大小可用于估算化学反应的反应热(ΔH),已知
化学健 | H-H | Cl-Cl | H-Cl |
键能 | 436 kJ/mol | 243 kJ/mol | 431 kJ/mol |
化学健 | H-H | Cl-Cl | H-Cl |
键能 | 436 kJ/mol | 243 kJ/mol | 431 kJ/mol |
则下列热化学方程式不正确的是( )
A.![]() H2(g)+
H2(g)+ ![]() Cl2(g)===HCl(g) ΔH=+91.5 kJ·mol-1
Cl2(g)===HCl(g) ΔH=+91.5 kJ·mol-1
B.H2(g)+Cl2(g)===2HCl(g) ΔH=-183 kJ·mol-1
C.2HCl(g)===H2(g)+Cl2(g) ΔH=+183 kJ·mol-1
D.![]() H2(g)+
H2(g)+![]() Cl2(g)===HCl(g) ΔH=-91.5 kJ·mol-1
Cl2(g)===HCl(g) ΔH=-91.5 kJ·mol-1
【答案】A
【解析】
试题分析:A.![]() H2(g)+
H2(g)+ ![]() Cl2(g)=HCl(g);△H=
Cl2(g)=HCl(g);△H=![]() ×436kJ·mol-1+
×436kJ·mol-1+![]() ×243kJ·mol-1 -431kJ·mol-1 =-91.5kJ?mol-1,故A错误;D正确;B.H2(g)+Cl2(g)=2HCl(g);△H=436kJ·mol-1+243kJ·mol-1-(2×431)kJ·mol-1=-183kJ·mol-1,故B正确;C.2HCl(g)=H2(g)+Cl2(g);△H=(2×431)kJ·mol-1-(436kJ·mol-1+243kJ·mol-1)△H=+183kJ·mol-1,故C正确;故选A。
×243kJ·mol-1 -431kJ·mol-1 =-91.5kJ?mol-1,故A错误;D正确;B.H2(g)+Cl2(g)=2HCl(g);△H=436kJ·mol-1+243kJ·mol-1-(2×431)kJ·mol-1=-183kJ·mol-1,故B正确;C.2HCl(g)=H2(g)+Cl2(g);△H=(2×431)kJ·mol-1-(436kJ·mol-1+243kJ·mol-1)△H=+183kJ·mol-1,故C正确;故选A。

【题目】下表中的数据是破坏1mol物质中的化学键所消耗的能量(kJ):
物质 | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
能量(kJ) | 243 | 193 | 151 | 432 | 366 | 298 | 436 |
根据上述数据回答下列问题:
(1)下列物质本身具有的能量最低的是 。
A.H2 B.Cl2C.Br2D.I2
(2)X2+H2![]() 2HX (X代表Cl、Br、I)的反应是放热反应还是吸热反应?
2HX (X代表Cl、Br、I)的反应是放热反应还是吸热反应?
(3)相同条件下,X2(X代表Cl、Br、I)分别与氢气反应,当消耗等物质的量的氢气时,放出或吸收的热量最多的是 。
(4)若无上表中的数据,你能回答问题(3)吗? (回答“能”或“不能”)。你的依据是 。