题目内容
【题目】已知A、B、C、D、E是化学中常见的物质,常温下,E是一种无色无味的液体,它们之间有如下反应关系。
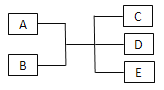
(1)若A是一种红色金属单质,B是一种常见的挥发性酸,反应时生成的C是无色气体,反应的离子方程式为___________,若反应放出1.12 L气体(标准状况下),则被还原的B物质的量为___________mol。
(2)若实验室中利用固体A和B的反应制备气体C,C是一种无色、刺激性气味、密度比空气小、碱性的气体,试写出此反应的化学方程式________________;实验室检验C的方法为_______________。
(3)若B是黄绿色有毒气体,上述关系经常用于实验室尾气处理,则反应的离子方程式为________________。若用湿润的淀粉碘化钾试纸靠近盛满B的试管口,看到的现象为______________。
【答案】2NO3-+ 3Cu + 8H+ = 2NO↑+ 4H2O + 3 Cu 2+0.052NH4Cl+ Ca(OH)2![]() CaCl2 +2NH3↑+2H2O把湿润的红色石蕊试纸靠近气体,若试纸变蓝,则证明该气体为氨气Cl2+2OH-=Cl-+ClO- + H2O试纸变为蓝色
CaCl2 +2NH3↑+2H2O把湿润的红色石蕊试纸靠近气体,若试纸变蓝,则证明该气体为氨气Cl2+2OH-=Cl-+ClO- + H2O试纸变为蓝色
【解析】A、B、C、D、E是化学中常见的物质,常温下,E是一种无色无味的液体,考虑E为H2O;
(1)A是一种红色单质,B是一种常见的挥发性酸,反应时生成的C是无色气体,则A为Cu,B为稀硝酸,C为NO,D为硝酸铜,反应的离子反应为2NO3-+3Cu+8H+=2NO↑+4H2O+3Cu2+,生成硝酸铜体现硝酸的酸性,生成NO体现硝酸的氧化性;若反应放出1.12 LNO气体(标准状况下),NO的物质的量为0.05mol,则被还原的HNO3物质的量为0.05mol;
(2)C是一种无色、刺激性气味、密度比空气小的气体,则C为NH3,实验室利用铵盐与熟石灰反应制备氨气,该反应方程式为:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O,检验方法为把湿润的红色石蕊试纸靠近气体,若试纸变蓝,则证明该气体为氨气(或用蘸有浓盐酸的玻璃棒靠近该气体,若有白烟生成,则证明该气体为氨气);
CaCl2+2NH3↑+2H2O,检验方法为把湿润的红色石蕊试纸靠近气体,若试纸变蓝,则证明该气体为氨气(或用蘸有浓盐酸的玻璃棒靠近该气体,若有白烟生成,则证明该气体为氨气);
(3)若B是黄绿色有毒气体,应该为氯气,实验室常用NaOH溶液吸收其尾气,则反应的离子方程式为Cl2+2OH-=Cl-+ClO- + H2O ;若用湿润的淀粉碘化钾试纸靠近盛满B的试管口,氯气能氧化I-生成碘单质,则看到的现象为试纸变为蓝色。