题目内容
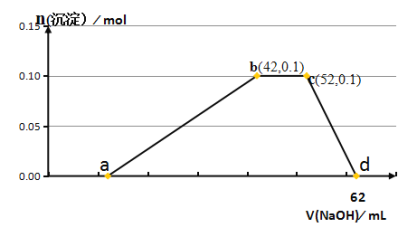
【题目】25℃时,向![]() 溶液中逐滴滴入
溶液中逐滴滴入![]() 溶液,溶液的pH与
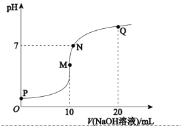
溶液,溶液的pH与![]() 溶液体积关系如图所示:(忽略溶液体积变化,且无气体产生)
溶液体积关系如图所示:(忽略溶液体积变化,且无气体产生)
(1)用化学用语表示M点![]() 的原因__________。
的原因__________。
(2)![]() 四点中,水电离产生的
四点中,水电离产生的![]() 浓度最大的是______________点。
浓度最大的是______________点。
(3)下列关系中,正确的是________。
a P点![]()
b N点![]()
c Q点![]()
d ![]() 溶液中
溶液中![]() 小于
小于![]() 溶液中
溶液中![]()
【答案】![]() M bc
M bc
【解析】
(1)M点为硫酸铵溶液,硫酸铵为强电解质,在溶液中完全电离出铵根离子和硫酸根离子,铵根离子水解使溶液呈酸性;
(2) M点溶质为硫酸铵和硫酸钠,铵根离子水解促进了水的电离,而Q溶质为硫酸钠和一水合氨,溶液呈碱性,氨水中氢氧根离子抑制了水的电离;
(3)a.P溶液只有NH4HSO4,NH4HSO4为强电解质,在溶液中完全电离:NH4HSO4=NH4++H++SO42,溶液显酸性,同时铵根离子水解生成H+;
b.N点溶液呈中性,c(H+)=c(OH-),结合电荷守恒判断;
c.Q点溶质为等浓度的硫酸钠和一水合氨,结合物料守恒判断;
d.NH4HSO4可电离出氢离子,抑制NH4+水解。
(1)M点为硫酸铵溶液,硫酸铵为强电解质,在溶液中完全电离出铵根离子和硫酸根离子,铵根离子水解NH4++H2ONH3H2O+H+,溶液呈酸性,所以此时溶液的pH<7;
(2)根据图示可知,P点呈强酸性,抑制了水的电离;M点加入10mLNaOH溶液,此时二者恰好反应生成硫酸钠和硫酸铵,铵根离子发生水解,促进了水的电离;N点为中性,不影响水的电离;Q点加入20mLNaOH溶液,此时溶质为硫酸钠和NH3H2O,氨水电离出的氢氧根离子抑制了水的电离;所以水的电离程度较大的为M点;
(3)a.P点溶液只有NH4HSO4,NH4HSO4为强电解质,在溶液中完全电离:NH4HSO4=NH4++H++SO42,溶液显酸性,c(H+)>c(OH),同时铵根离子水解生成H+,则c(H+)>c(SO42)>c(NH4+)>c(OH),故a错误;
b.N点溶液呈中性,则c(H+)=c(OH),结合电荷守恒c(H+)+c(NH4+)+c(Na+)=2c(SO42)+c(OH)可知:c(NH4+)+c(Na+)=2c(SO42),故b正确;
c.Q点溶质为等浓度的硫酸钠和一水合氨,结合物料守恒可知:2c(NH4+)+2c(NH3H2O)=c(Na+),故c正确;
d.NH4HSO4和NH4Cl溶液中铵根离子都能发生水解,但NH4HSO4可电离出氢离子,抑制NH4+水解,则浓度相等的两溶液中,NH4HSO4溶液中铵根离子浓度大于NH4Cl溶液中的铵根离子浓度,故d错误;
答案选bc。

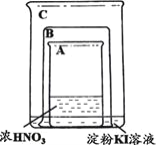
【题目】某同学进行下列实验:
装置 | 操作 | 现象 |
| 将盛有浓硝酸的烧杯A放入盛有淀粉KI溶液的烧杯C中,然后将铜片放入烧杯A后,立即用烧杯B罩住。 | 烧杯A液体上方立即出现大量红棕色气体;一段时间后,红棕色气体消失,烧杯A和C中的液体都变成蓝色。 |
下列说法不合理的是
A.烧杯A中发生反应:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
B.红棕色气体消失可能与NO2和烧杯C中的KI发生反应有关
C.烧杯A中溶液变蓝是因为产生了Cu(NO3)2
D.若将铜片换成铁片,则C中的液体不会变蓝