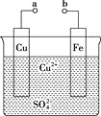
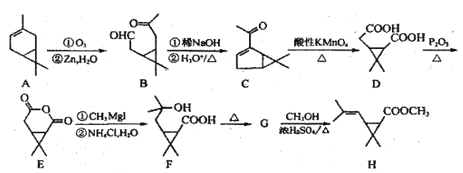
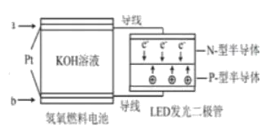
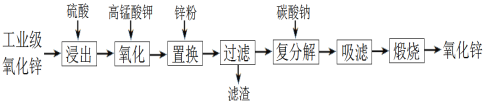
题目内容
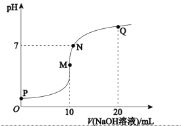
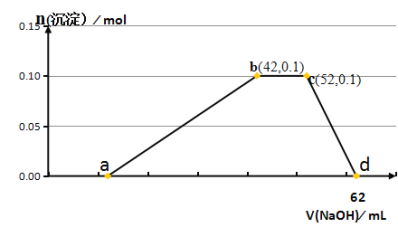
【题目】某研究小组取50g含十二水硫酸铝铵〔NH4Al(SO4)2·12H2O俗称铝铵矾〕的样品投入200mL稀硫酸中,待固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系如图所示:
(假设铝铵矾中的杂质不溶于H2SO4,也不溶于NaOH)
请回答下列问题:
(1)cd段反应的离子方程式是___;
(2)图中b点溶液中的溶质有___;
(3)铝铵矾溶于水时的电离方程式是___;
(4)H2SO4的物质的量的浓度为___;
(5)该样品中铝铵矾的质量分数为___。
【答案】Al(OH)3+OH-=AlO![]() +2H2O Na2SO4、(NH4)2SO4 NH4Al(SO4)2=NH
+2H2O Na2SO4、(NH4)2SO4 NH4Al(SO4)2=NH![]() +Al3++2SO
+Al3++2SO![]() 0.3molL-1 90.6℅
0.3molL-1 90.6℅
【解析】
由图像可知,a点前是氢氧化钠和剩余的酸反应,a-b是铝离子和氢氧化钠产生0.1mol的氢氧化铝沉淀,b-c是铵根和10 mL氢氧化钠溶液反应产生氨水,c-d是0.1mol氢氧化铝和10 mL氢氧化钠溶液反应生成偏铝酸钠。
(1)由图像可知,cd段是0.1mol氢氧化铝和10 mL氢氧化钠溶液反应生成偏铝酸钠和水,离子方程式是Al(OH)3+OH-=AlO![]() +2H2O,故答案为:Al(OH)3+OH-=AlO
+2H2O,故答案为:Al(OH)3+OH-=AlO![]() +2H2O;
+2H2O;
(2)由图像可知,b点时,铝离子刚好完全沉淀,溶液中剩余Na2SO4、(NH4)2SO4,故本题答案为:Na2SO4、(NH4)2SO4;
(3)铝铵矾是强电解质,全部电离,溶于水时的电离方程式为NH4Al(SO4)2=NH![]() +Al3++2SO
+Al3++2SO![]() ,故本题答案为:NH4Al(SO4)2=NH
,故本题答案为:NH4Al(SO4)2=NH![]() +Al3++2SO
+Al3++2SO![]() ;
;
(4)由c-d段可知,根据Al(OH)3+OH-=AlO![]() +2H2O,0.1mol氢氧化铝需要消耗0.1mol氢氧化钠溶液,则氢氧化钠浓度为:c=0.1mol/0.01L=10mol/L,a-b段产生0.1mol氢氧化铝,则需消耗氢氧化钠为0.3mol,氢氧化钠体积为:0.3mol/10mol/L=0.03L=30mL,则a点的值为12mL,a点前是氢氧化钠和硫酸按照2:1进行反应,则硫酸的物质的量为:
+2H2O,0.1mol氢氧化铝需要消耗0.1mol氢氧化钠溶液,则氢氧化钠浓度为:c=0.1mol/0.01L=10mol/L,a-b段产生0.1mol氢氧化铝,则需消耗氢氧化钠为0.3mol,氢氧化钠体积为:0.3mol/10mol/L=0.03L=30mL,则a点的值为12mL,a点前是氢氧化钠和硫酸按照2:1进行反应,则硫酸的物质的量为: 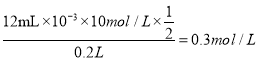 ,故H2SO4的物质的量的浓度为;0.3molL-1;
,故H2SO4的物质的量的浓度为;0.3molL-1;
(5)根据铝元素守恒,十二水硫酸铝铵〔NH4Al(SO4)2·12H2O的物质的量为0.1mol,则十二水硫酸铝铵的质量为45.3g,该样品中铝铵矾的质量分数为![]() ,故本题答案为:90.6%。
,故本题答案为:90.6%。