题目内容
2.下列有关说法正确的是( )| A. | 向NH4HCO3溶液中加过量的NaOH溶液并加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| B. | 某温度下,在体积一定的密闭容器中适量的NH3气和Cl2气恰好完全反应,产物只有N2气和NH4Cl固体,则反应前后容器中的压强比接近于11:1 | |
| C. | AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同 | |
| D. | 向Fe(OH)3胶体中逐滴滴加入过量HI出现先沉淀后溶解现象,最后得到无色溶液 |
分析 A.反应中生成碳酸钠和氨气;
B.根据反应中气体物质的量的变化分析;
C.增大氯离子的浓度,氯化银的溶解平衡逆移;
D.三价铁离子能把碘离子氧化为单质碘.
解答 解:A.向NH4HCO3溶液中加过量的NaOH溶液并加热,反应中生成碳酸钠和氨气,其离子方程式为:HCO3-+NH4++2OH-$\frac{\underline{\;\;△\;\;}}{\;}$CO32-+NH3↑+2H2O,故A错误;
B.某温度下,在体积一定的密闭容器中适量的NH3气和Cl2气恰好完全反应,产物只有N2气和NH4Cl固体,反应方程式为8NH3+3Cl2=N2+6NH4Cl,则反应前后容器中的压强比接近于11:1,故B正确;
C.增大氯离子的浓度,氯化银的溶解平衡逆移,所以AgCl在同浓度的CaCl2和NaCl溶液,前者溶液中的AgCl的溶解度小,故C错误;
D.向Fe(OH)3胶体中逐滴滴加入过量HI,开始反应生成三价铁离子,三价铁离子能把碘离子氧化为单质碘,所以反应后溶液为棕黄色,故D错误.
故选B.
点评 本题考查了离子反应、氧化还原反应、物质的性质、沉淀溶解平衡等,题目涉及的知识点较多,侧重于基础知识的考查,难度不大.

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案
相关题目
8.用NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 1.00mol NaCl中含有NA个NaCl分子 | |
| B. | 1 mol 明矾与水完全反应转化为氢氧化铝胶体后,其中胶体粒子的数目为NA | |
| C. | 欲配制1.00L,1.00mol.L-1的NaCl溶液,可将58.5g NaCl溶于1.00L水中 | |
| D. | 实验室以H2O2和MnO2为原料制取O2,每生成1mol O2转移2NA个电子 |
10.将充满20mL NO试管倒置于盛有蒸馏水的烧杯中,然后向试管中通入纯O2,当试管内液面稳定在试管容积的一半时,则通入O2为( )
| A. | 7.5 mL | B. | 15.0 mL | C. | 17.5 mL | D. | 35.0 mL |
17.一定温度下,在一固定体积的密闭容器中,可逆反应A(s)+3B(g)?2C(g)达到平衡时,下列说法正确的是( )
①C的生成速率和C的分解速率相等 ②单位时间内生成a mol A,同时生成3a mol B
③气体密度不再变化 ④混合气体的总压强不再变化 ⑤A、B、C的物质的量之比为1:3:2
⑥混合气体的平均相对分子质量不变.
①C的生成速率和C的分解速率相等 ②单位时间内生成a mol A,同时生成3a mol B
③气体密度不再变化 ④混合气体的总压强不再变化 ⑤A、B、C的物质的量之比为1:3:2
⑥混合气体的平均相对分子质量不变.
| A. | ②④⑤ | B. | ①③④⑥ | C. | ①②④⑥ | D. | ①②③④⑤ |
14.100℃时pH=3的盐酸和pH=9的氢氧化钠溶液以体积比11:9混合,混合液的pH为( )
| A. | 约3.3 | B. | 8 | C. | 6 | D. | 4 |
12.下列各组物质中化学键的类型相同的是( )
| A. | HCl MgCl2 NH4Cl | B. | H2O Na2O ? CO2 | ||
| C. | NH3 H2O CO2 | D. | CaCl2 ? NaOH H2O |
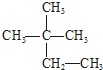 ③C60 ④氯气 ⑤
③C60 ④氯气 ⑤ ⑥液氯 ⑦石墨 ⑧${\;}_{17}^{35}$Cl.
⑥液氯 ⑦石墨 ⑧${\;}_{17}^{35}$Cl.