题目内容
7.(1)分析下列物质的物理性质,判断其晶体类型:①碳化铝,黄色晶体,熔点2200℃,熔融态不导电原子晶体;
②溴化铝,无色晶体,熔点98℃,熔融态不导电,水溶液能导电分子晶体;
③五氟化钒,无色晶体,熔点19.5℃,易溶于CS2、CCl4等有机溶剂分子晶体;
④溴化钾,无色晶体,熔融态或溶于水中均能导电离子晶体;
(2)最近科学家研究发现了首例带结晶水的化学式为Na0.35CoO2•1.3H2O.若用NA表示阿伏加德罗常数,试计算12.2g该晶体含氧原子数0.33NA,氢原子数的物质的量0.26 mol.
分析 (1)根据原子晶体、分子晶体、离子晶体、金属晶体的特点和性质分析;
(2)根据化学式和相对原子质量来计算相对分子质量,相对分子质量与摩尔质量的数值相同,单位不同,并利用化学式来确定原子的关系及N=n×NA来解答.
解答 解:(1)①原子晶体属于共价化合物,固态、液态时均不导电,而且熔点很高,故答案为:原子晶体;
②熔点低,熔融态不导电,所以是分子晶体,故答案为:分子晶体;
③根据相似相溶原理,非极性分子形成的晶体易溶于乙醇、氯仿、丙酮,难溶于水,故答案为:分子晶体;
④离子晶体熔融时或溶于水中都能导电,故答案为:离子晶体;
(2)晶体的化学式为 Na0.35CoO2•1.3H2O,其相对分子质量为
23×0.35+59+16×2+1.3×(1×2+16)=122.45,
则该晶体的摩尔质量是122.45g/mol,
12.2g该晶体的物质的量为:$\frac{12.2g}{122.45g/mol}$=0.1mol,0.1mol该晶体中含有的氧原子数目为0.1×(2+1.3)×NA=0.33NA,氢原子数的物质的量2.6×0.1=0.26mol,
故答案为:0.33NA,.
点评 本题考查晶体的类型的判断和物质的量的相关计算,为高频考点,侧重于学生的分析能力和计算能力的考查,明确常见原子的相对原子质量及物质的构成是解答本题的关键,难度不大,注意相关计算公式的运用.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
12.已知H2(g)+Br2(l)═2HBr(g)△H=-72kJ•mol-1.蒸发1mol Br2(l)需要吸收的能量为30kJ,其它相关数据如表:
则表中a为D.
A.404 B.260 C.230 D.200.
| H2(g) | Br2(g) | HBr(g) | |
| 1 mol分子中的化学键断裂时需要吸收的能量/kJ | 436 | a | 369 |
A.404 B.260 C.230 D.200.
13.常温下,下列溶液中各组离子一定能大量共存的是( )
| A. | 加入KSCN显血红色的溶液:Na+、NH4+、Cl-、I- | |
| B. | 使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3-、Cl- | |
| C. | 0.1 mol•L-1的NaOH溶液:K+、SiO32-、NO3-、SO42- | |
| D. | 通入足量SO2后的溶液:Na+、NH4+、ClO-、CH3COO- |
15.下列物质既能与强酸反应又能和强碱反应的是( )
①Al ②Fe3O4③NaHCO3 ④Al(OH)3⑤Na2CO3.
①Al ②Fe3O4③NaHCO3 ④Al(OH)3⑤Na2CO3.
| A. | ①②④ | B. | ②③⑤ | C. | ①③④ | D. | ②④⑤ |
2.下列有关说法正确的是( )
| A. | 向NH4HCO3溶液中加过量的NaOH溶液并加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| B. | 某温度下,在体积一定的密闭容器中适量的NH3气和Cl2气恰好完全反应,产物只有N2气和NH4Cl固体,则反应前后容器中的压强比接近于11:1 | |
| C. | AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同 | |
| D. | 向Fe(OH)3胶体中逐滴滴加入过量HI出现先沉淀后溶解现象,最后得到无色溶液 |
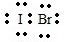 ,它是由极性共价键形成的共价化合物.
,它是由极性共价键形成的共价化合物.