题目内容
(1)AgNO3的水溶液呈酸性的原因是(用离子方程式表示): ;实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以 (填“促进”、“抑制”)其水解。
(2)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,充分反应后溶液呈中性,则反应后溶液存在的离子有 ,其浓度由大到小的顺序为 ,氨水的浓度a 0.01 mol·L-1(填“>”、“<”或“=”)。
(3)用已知浓度的NaOH标准溶液滴定未知浓度的盐酸,选用酚酞为指示剂,造成测定结果偏高的原因可能是
| A.未用标准液润洗碱式滴定管; |
| B.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液; |
| C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗; |
| D.滴定终点读数时,俯视滴定管的刻度,其它操作均正确; |
⑴Ag++ H2O 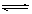 AgOH +H+ 抑制
AgOH +H+ 抑制
⑵OH-、H+、NH4+、Cl- c(Cl-)=c(NH4+)>c(H+)=c(OH-) >
⑶AB
解析试题分析:(1)银离子在水溶液中可发生水解,有氢离子生成,所以溶液显酸性。硝酸中会存在大量的氢离子,所以可以抑制硝酸银的水解(2)产物是氯化铵和水,所以溶液中会存在氢氧根离子、氢离子、铵根离子、氯离子。主要产物是氯化铵,而铵根离子会发生水解生成氢氧根离子,而从题意可知溶液呈中性,所以排序为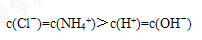
考点:盐类水解相关知识的应用

下列叙述正确的是
| A.0.1 mol·L-1醋酸溶液中:c(H+)= c(CH3COO-)+c(OH-) |
| B.中和pH与体积都相同的硫酸和醋酸,消耗NaOH的量后者大于前者 |
| C.同温度同浓度的NaOH和澄清石灰水中,水的电离程度相同 |
| D.NaHCO3溶液中:c(Na+)>c(HCO3-)>c(H2CO3)>c(OH-)>c(H+) |
(6分)
(1)下列化学原理的应用,主要用沉淀溶解平衡原理来解释的是 :
①热纯碱溶液洗涤油污的能力比冷纯碱溶液强;②误将钡盐[BaCl2、Ba(NO3)2]当作食盐食用时,常用0.5%的Na2SO4溶液解毒;③石灰岩(喀斯特地貌)的溶洞形成;④BaCO3不能做“钡餐”,而BaSO4则可以;⑤使用泡沫灭火器时“泡沫”生成的原理。
| A.②③④ | B.①②③ | C.③④⑤ | D.①②③④⑤ |
把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是 。
(6分)水溶液中存在水的电离平衡。
(1)常温时,在稀溶液中c(H+)和c(OH-)的乘积总是等于 。
(2)用“>”、“<”或“=”填空: 碱性溶液中,c(H+) c(OH-),在常温时pH 7。
(3)有下列几种溶液:
| A.NH3·H2O | B.CH3COONa | C.NH4Cl | D.NaHSO4 |
用离子方程式或电离方程式表示这些溶液呈酸性的原因:___________________________________。
(12分)常温下,将某一元碱BOH和HCl溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 | HCl的物质的量浓度 (mol·L-1) | BOH的物质的量浓度 (mol·L-1) | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=5 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.1 | 0.2 | pH>7 |
(1)从第①组情况分析,BOH是 (选填“强碱”或“弱碱”)。该组所得混合溶液中由水电离出的
c(OH—)= mol·L-1。
(2)第②组情况表明,c 0.2。该混合液中离子浓度c(B+) c(Cl—)(选填“<”、“>”或“=”)。
(3)从第③组实验结果分析,混合溶液中 (选填“<”、“>”或“=”)
甲:BOH的电离程度 BCl的水解程度
乙:c(B+)—2 c (OH—) c(BOH)—2 c(H+)


 CoO2+ LiC6。LiC6中Li的化合价为 价。若放电时有1mole-转移,正极质量增加 g。
CoO2+ LiC6。LiC6中Li的化合价为 价。若放电时有1mole-转移,正极质量增加 g。