题目内容
(12分)常温下,将某一元碱BOH和HCl溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 | HCl的物质的量浓度 (mol·L-1) | BOH的物质的量浓度 (mol·L-1) | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=5 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.1 | 0.2 | pH>7 |
(1)从第①组情况分析,BOH是 (选填“强碱”或“弱碱”)。该组所得混合溶液中由水电离出的
c(OH—)= mol·L-1。
(2)第②组情况表明,c 0.2。该混合液中离子浓度c(B+) c(Cl—)(选填“<”、“>”或“=”)。
(3)从第③组实验结果分析,混合溶液中 (选填“<”、“>”或“=”)
甲:BOH的电离程度 BCl的水解程度
乙:c(B+)—2 c (OH—) c(BOH)—2 c(H+)
(12分)(每空2分)(1) 弱碱; 1×10—5 (2)<; = (3) >; =
解析试题分析:(1)①中酸和碱恰好完全反应生成盐,盐溶液水解显酸性,故为强酸弱碱盐,所以BOH为弱碱,盐的水解促进了水的电离,盐溶液中的氢离子均是水电离出的,c(H+)=10-5mol/L,故由水电离出的氢离子等于由水电离出的氢氧根离子,故由水电离出的c(OH—)=10-5mol/L;(2)恰好完全反应时溶液显酸性,现溶液显中性,说明碱过量,故酸的浓度小于0.2mol/L;根据电荷守恒c(B+)+c(H+)=c(Cl-)+c(OH-),因c(H+)=c(OH-),故c(B+)=c(Cl—);(3)反应后溶液中BOH和BCl的浓度相等,溶液显碱性,说明碱的电离程度大于盐的水解程度;溶液中存在电荷守恒C(H+)+C(B+ )=C(OH-)+C(Cl- ),根据物料守恒得c(B+)+c(BOH)=2C(Cl- ),将电荷守恒关系式两边同时乘以2,用c(B+)-2c (OH-)将2c(Cl-)替换得c(B+)-2c (OH-)=c(BOH)-2c(H+)。
考点:酸碱混合时的判断、离子浓度的比较、pH的判断、盐的水解等知识。

对于常温下0.1mol·L-1 NaHCO3溶液,下列叙述不正确的是( )
| A.c (Na+)="c" (HCO3-) + c (CO32-) + c (H2CO3) |
| B.温度升高,溶液的pH升高,但溶液中的c(H+)与c(OH-)乘积不变 |
| C.与等体积等浓度的CH3COOH溶液反应后,溶液中c(Na+)>c(CH3COO-) |
| D.加入适量的NaOH固体,溶液的pH减小 |
向20.00mL稀H2SO4中逐滴加入0.10mol/L的氨水,测得溶液的pH随加入氨水的体积变化如图所示。下列判断正确的是( ) 
| A.x=20 |
| B.稀H2SO4的浓度为0.10mol/L |
| C.b点有:2c(NH4+) = c(SO42-)> c(H+) = c(OH-) |
| D.a点有:c(NH4+) < 2c(SO42-) |
(8分)硫酸镁在医疗上具有镇静、抗挛等功效。以菱镁矿(主要成分是MgCO3)为主要原料制备硫酸镁的方法如下: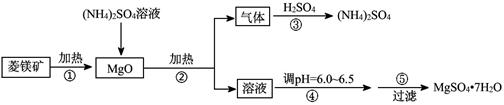
(1)步骤②中发生反应的离子方程式为 。
(2)步骤④中调节pH=6.0~6.5的目的是 。
(3)步骤⑤的操作为
(4)已知酸碱指示剂百里酚蓝变色的pH范围如表所示:
| pH | < 8.0 | 8.0 ~ 9.6 | > 9.6 |
| 颜色 | 黄色 | 绿色 | 蓝色 |
(1)AgNO3的水溶液呈酸性的原因是(用离子方程式表示): ;实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以 (填“促进”、“抑制”)其水解。
(2)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,充分反应后溶液呈中性,则反应后溶液存在的离子有 ,其浓度由大到小的顺序为 ,氨水的浓度a 0.01 mol·L-1(填“>”、“<”或“=”)。
(3)用已知浓度的NaOH标准溶液滴定未知浓度的盐酸,选用酚酞为指示剂,造成测定结果偏高的原因可能是
| A.未用标准液润洗碱式滴定管; |
| B.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液; |
| C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗; |
| D.滴定终点读数时,俯视滴定管的刻度,其它操作均正确; |
在稀氨水中存在下述电离平衡NH3+H2O NH3 ·H2O
NH3 ·H2O NH4++OH-,分别加入少量下列物质,溶液中c(OH-)如何变化?(填“增大”“减小”或“不变”);平衡移动方向如何?(填“正向”“逆向”或“不移动”)
NH4++OH-,分别加入少量下列物质,溶液中c(OH-)如何变化?(填“增大”“减小”或“不变”);平衡移动方向如何?(填“正向”“逆向”或“不移动”)
| 加入的物质 | 少量(NH4)2SO4固体 | 少量HNO3溶液 | 少量KOH溶液 |
| c(OH-)的变化 | | | |
| 平衡移动方向 | | | |
某学生用0.100 mol·L-1的KOH标准溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
| A.移取20.00 mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞; |
| B.用标准溶液润洗滴定管2~3次; |
| C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液; |
| D.取标准KOH溶液注入碱式滴定管至刻度“0”以上2~3 mL; |
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度。
就此实验完成填空:
(1)正确操作步骤的顺序是(用字母序号填写) 。
(2)上述B步骤操作的目的是 。
(3)上述A步骤操作之前,若先用待测溶液润洗锥形瓶,则滴定结果 (填“偏高”“偏低”或“不变”)。
(4)判断到达滴定终点的实验现象是 。
