题目内容
(6分)
(1)下列化学原理的应用,主要用沉淀溶解平衡原理来解释的是 :
①热纯碱溶液洗涤油污的能力比冷纯碱溶液强;②误将钡盐[BaCl2、Ba(NO3)2]当作食盐食用时,常用0.5%的Na2SO4溶液解毒;③石灰岩(喀斯特地貌)的溶洞形成;④BaCO3不能做“钡餐”,而BaSO4则可以;⑤使用泡沫灭火器时“泡沫”生成的原理。
| A.②③④ | B.①②③ | C.③④⑤ | D.①②③④⑤ |
把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是 。
(1)A (2)酸 Al3+ +3H2O Al(OH)3+3H+ Al2O3
Al(OH)3+3H+ Al2O3
解析试题分析:①热纯碱溶液洗涤油污的能力比冷纯碱溶液强是因为纯碱是强碱弱酸盐,水解使溶液显碱性。而盐的水解反应是吸热反应,所以升高温度促进盐的水解,因此去污能力强。与沉淀溶解平衡无关,错误;②误将钡盐[BaCl2、Ba(NO3)2]当作食盐食用时,若服用0.5%的Na2SO4溶液,就会发生沉淀反应产生BaSO4沉淀,降低了人体内的Ba2+的浓度,从而达到解毒的目的,这与沉淀溶解平衡有关,正确;③当水中含有CO2等酸性气体时就会发生反应产生容易溶解于水碳酸氢盐,随水分而流失,从而促进了盐的溶解和电离,盐再溶解,最后逐步形成石灰岩(喀斯特地貌)的溶洞;这与沉淀溶解平衡有关,正确;⑤使用泡沫灭火器时是盐的双水解反应相互促进,产生更多的Al(OH)3,在CO2的气体压力作用下以泡沫的形式出现,“泡沫”生成的原理与沉淀溶解平衡无关,错误。故正确的说法是②③④,故选项是A。(2)氯化铝是强酸弱碱盐,若碱根离子水解消耗水电离产生的OH-,最终当溶液处于平衡时, c(H+)>c(OH-),所以溶液呈酸性;水解的离子方程式表示为Al3+ +3H2O Al(OH)3+3H+ 。水解产生的HCl会随着水分的蒸发而挥发,所以蒸干得到的固体是Al(OH)3,若再灼烧,则Al(OH)3发生分解反应产生Al2O3和水,所以最后得到的主要固体产物是Al2O3。
Al(OH)3+3H+ 。水解产生的HCl会随着水分的蒸发而挥发,所以蒸干得到的固体是Al(OH)3,若再灼烧,则Al(OH)3发生分解反应产生Al2O3和水,所以最后得到的主要固体产物是Al2O3。
考点:考查盐的水解平衡、沉淀溶解平衡及盐水解的应用的知识。

化学知识在生活中有重要意义,下列说法不正确的是
| A.草木灰(含有K2CO3)水溶液可以用于洗涤油污 |
| B.乙醇、乙酸和甲醛广泛应用于食品加工 |
| C.捕获排放的CO2能降低地球的温室效应 |
| D.在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 |
25℃时,有c(CH3COOH)+c(CH3COO-)=" 0." 1 mol·L-1的一组醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH 的关系如图所示。下列有关溶液中离子浓度关系的叙述正确的是
| A.X点所表示的溶液中:c(Na+)+ c(OH-) = c(CH3COO-) + c(H+) |
| B.W 点所表示的溶液中:c(Na+) +c(H+) -c(OH-) +c(CH3COOH)=" 0." 1mol·L-1 |
| C.该温度下醋酸的电离平衡常数为10-4.75 mol·L-1 |
| D.向X点所表示的溶液中加入等体积的0. 05mol·L-1NaOH溶液:c(H+)= c(CH3COOH)+c(OH-) |
向20.00mL稀H2SO4中逐滴加入0.10mol/L的氨水,测得溶液的pH随加入氨水的体积变化如图所示。下列判断正确的是( ) 
| A.x=20 |
| B.稀H2SO4的浓度为0.10mol/L |
| C.b点有:2c(NH4+) = c(SO42-)> c(H+) = c(OH-) |
| D.a点有:c(NH4+) < 2c(SO42-) |
下列关于0.1 mol·L-1CH3COONa溶液的说法正确的是 ( )
| A.加入少量NaOH固体,c(CH3COO-)增大 |
| B.加入少量FeCl3固体,c(CH3COO-)增大 |
| C.稀释溶液,溶液的pH增大 |
| D.加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-) |
(8分)硫酸镁在医疗上具有镇静、抗挛等功效。以菱镁矿(主要成分是MgCO3)为主要原料制备硫酸镁的方法如下: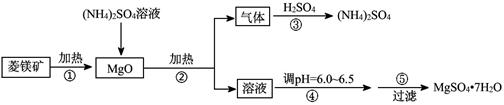
(1)步骤②中发生反应的离子方程式为 。
(2)步骤④中调节pH=6.0~6.5的目的是 。
(3)步骤⑤的操作为
(4)已知酸碱指示剂百里酚蓝变色的pH范围如表所示:
| pH | < 8.0 | 8.0 ~ 9.6 | > 9.6 |
| 颜色 | 黄色 | 绿色 | 蓝色 |
(1)AgNO3的水溶液呈酸性的原因是(用离子方程式表示): ;实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以 (填“促进”、“抑制”)其水解。
(2)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,充分反应后溶液呈中性,则反应后溶液存在的离子有 ,其浓度由大到小的顺序为 ,氨水的浓度a 0.01 mol·L-1(填“>”、“<”或“=”)。
(3)用已知浓度的NaOH标准溶液滴定未知浓度的盐酸,选用酚酞为指示剂,造成测定结果偏高的原因可能是
| A.未用标准液润洗碱式滴定管; |
| B.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液; |
| C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗; |
| D.滴定终点读数时,俯视滴定管的刻度,其它操作均正确; |
在稀氨水中存在下述电离平衡NH3+H2O NH3 ·H2O
NH3 ·H2O NH4++OH-,分别加入少量下列物质,溶液中c(OH-)如何变化?(填“增大”“减小”或“不变”);平衡移动方向如何?(填“正向”“逆向”或“不移动”)
NH4++OH-,分别加入少量下列物质,溶液中c(OH-)如何变化?(填“增大”“减小”或“不变”);平衡移动方向如何?(填“正向”“逆向”或“不移动”)
| 加入的物质 | 少量(NH4)2SO4固体 | 少量HNO3溶液 | 少量KOH溶液 |
| c(OH-)的变化 | | | |
| 平衡移动方向 | | | |