题目内容
20.实验室用二氧化锰和浓盐酸反应制取氯气,若有870g二氧化锰与足量的浓盐酸反应,则被氧化的氯化氢的物质的量是多少?产生的氯气在标况下的体积为多少L?反应中转移的电子数目?分析 发生反应:MnO2+4HCl?MnCl2+Cl2↑+2H2O,根据n=$\frac{m}{M}$计算二氧化锰物质的量,再根据方程式计算生成氯气物质的量,被氧化的HCl生成氯气,根据氯原子守恒计算被氧化HCl的物质的量,根据V=nVm计算氯气体积,结合氯元素化合价变化计算转移电子数目.
解答 解:870g MnO2 的物质的量为$\frac{870g}{87g/mol}$=10mol,
由MnO2+4HCl?MnCl2+Cl2↑+2H2O,可知n(Cl2)=n(MnO2)=10mol,
被氧化的HCl生成氯气,根据氯原子守恒,可知被氧化HCl的物质的量为10mol×2=20mol,
标况下,生成氯气的体积为10mol×22.4L/mol=224L,
转移电子数目为20mol×1×6.02×1023mol-1=1.204×1025,
答:被氧化的氯化氢的物质的量是20mol,产生的氯气在标况下的体积为224L,反应中转移的电子数目为1.204×1025.
点评 本题考查化学方程式计算、氧化还原反应计算等,难度不大,注意参加反应的盐酸与被氧化的盐酸的物质的量的关系.

练习册系列答案
相关题目
8.W,X,Y,Z均为短周期主族元素,原子序数依次增加,且原子核外L电子层的电子数分别为0,6,8,8,它们的最外层电子数之和为10,下列说法正确的是( )
| A. | W与Y可以形成离子化合物 | |
| B. | X的简单氢化物在同主族元素的氢化物中沸点最高,说明X的非金属性最强 | |
| C. | X和Z形成的原子个数1:1的化合物中,既含有极性键又含有非极性键 | |
| D. | 工业生产中,通常用电解Z的熔融氧化物来制取Z的单质 |
12.萘的结构简式为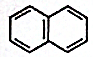 ,它与硝酸反应,可生成苯环上的一硝基取代物( )
,它与硝酸反应,可生成苯环上的一硝基取代物( )
 ,它与硝酸反应,可生成苯环上的一硝基取代物( )
,它与硝酸反应,可生成苯环上的一硝基取代物( )| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
15. (1)已知:N2(g)+O2(g)═2NO(g)△H=+180.5kJ/mol
(1)已知:N2(g)+O2(g)═2NO(g)△H=+180.5kJ/mol
N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ/mol
若有17g 氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为226.3kJ.
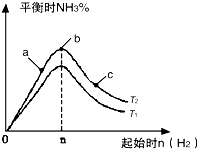
(2)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对N2(g)+3H2(g)?2NH3(g)反应的影响.实验结果如图所示:
(图中T表示温度,n表示物质的量)
①图象中T2和T1的关系是:T2低于T1(填“高于”“低于”“等于”“无法确定”)
②比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是c(填字母).
(3)N2O5是一种新型硝化剂,其性质和制备受到人们的关注.
一定温度下,在恒容密闭容器中N2O5可发生下列反应:2N2O5(g)═4NO2(g)+O2(g)△H>0下表为反应在T1温度下的部分实验数据
则500s内NO2的平均生成速率为0.00592 mol•L-1•s-1.
 (1)已知:N2(g)+O2(g)═2NO(g)△H=+180.5kJ/mol
(1)已知:N2(g)+O2(g)═2NO(g)△H=+180.5kJ/molN2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ/mol
若有17g 氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为226.3kJ.
(2)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对N2(g)+3H2(g)?2NH3(g)反应的影响.实验结果如图所示:
(图中T表示温度,n表示物质的量)
①图象中T2和T1的关系是:T2低于T1(填“高于”“低于”“等于”“无法确定”)
②比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是c(填字母).
(3)N2O5是一种新型硝化剂,其性质和制备受到人们的关注.
一定温度下,在恒容密闭容器中N2O5可发生下列反应:2N2O5(g)═4NO2(g)+O2(g)△H>0下表为反应在T1温度下的部分实验数据
| t/s | 0 | 500 | 1000 |
| c(N2O5)/mol•L-1 | 5.00 | 3.52 | 2.48 |
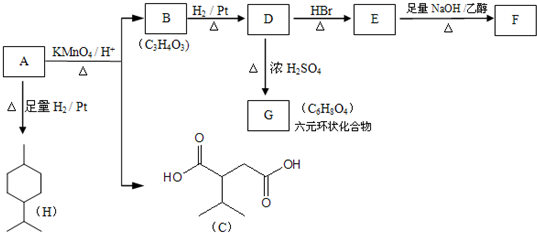
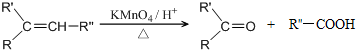
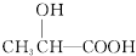 $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$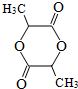 +2H2O.
+2H2O.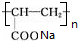 .
.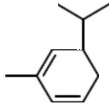 .
.