题目内容
10.雾霾严重影响人们的生活,汽车尾气排放是造成雾霾天气的重要原因之一.已知汽车尾气排放时容易发生以下反应:①N2(g)+O2(g)?2NO(g)△H1=a kJ•mol-1
②2NO(g)+O2(g)?2NO2(g)△H2=b kJ•mol-1
③CO(g)+$\frac{1}{2}$O2(g)?CO2(g)△H3=c kJ•mol-1
④2CO(g)+2NO(g)?N2(g)+2CO2(g)△H4
请回答下列问题:
(1)根据反应①②③,确定反应④中△H4=2c-akJ•mol-1.
(2)对于气体参与的反应,表示平衡常数Kp时用气体组分(B)的平衡压强p(B)代替该气体物质的量浓度c(B),则反应①的Kp=$\frac{{P}^{2}(NO)}{P({N}_{2})P({O}_{2})}$(用表达式表示).
(3)下列情况能说明反应②已达平衡状态的是CD(填编号).
A.单位时间内生成1mol NO2的同时消耗了lmol NO
B.在恒温恒容的容器中,混合气体的密度保持不变
C.在恒温恒容的容器中,混合气体的平均相对分子质量不再改变
D.在恒温恒压的容器中,NO的体积分数保持不变
(4)试分析高温下不利于反应③自发进行的原因因为该反应为气体体积减小的放热反应,即△H<0,△S<0.
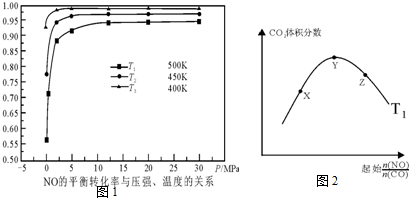
(5)探究反应④中NO的平衡转化率与压强、温度的关系,得到如图1所示的曲线.试分析实际化工生产中不采用高压的原因常压下NO的转化率已经较高,并且高压要增加成本.
(6)探究反应④中平衡时CO2的体积分数与反应物中$\frac{n(NO)}{n(CO)}$的比值、温度的关系,得到如图2所示的曲线.
①在X、Y、Z三点中,CO的转化率从大到小的顺序是Z>Y>X.
②若保持其他条件不变,请在图2中,画出温度为T2(T2<T1)时的变化趋势曲线.
分析 (1)根据盖斯定律,反应②×2-③即得,确定反应④2CO(g)+2NO(g)?N2(g)+2CO2(g),据此计算焓变;
(2)根据反应①的方程式得出Kp=$\frac{{P}^{2}(NO)}{P({N}_{2})P({O}_{2})}$;
(3)化学反应达到化学平衡状态时,正逆反应速率相等,且不等于0,各物质的浓度不再发生变化,由此衍生的一些物理量不发生变化,以此进行判断,得出正确结论(4)根据该反应为气体体积减小的放热反应结合△G=△H-T△S<0自发判断;
(5)根据图象分析,常压下NO的转化率已经较高,并且高压转化率增加不大,但增加成本较大,据此分析;
(6)①温度一定,随反应物NO、CO的起始物质的量比增大,X-Y反应正向进行,一氧化碳的转化率X<Y,Y-Z平衡正向进行,一氧化氮增大会提高一氧化碳的转化率,则Y<Z;
②根据图象1分析,温度越低NO的平衡转化率越大,说明该反应为放热反应,所以温度越低,平衡时二氧化碳的体积分数也越大,据此画图.
解答 解:(1)根据盖斯定律,反应②×2-③即得,确定反应④2CO(g)+2NO(g)?N2(g)+2CO2(g)△H4=(2c-a)KJ/mol,故答案为:2c-a;
(2)根据反应①的方程式得出Kp=$\frac{{P}^{2}(NO)}{P({N}_{2})P({O}_{2})}$,故答案为:$\frac{{P}^{2}(NO)}{P({N}_{2})P({O}_{2})}$;
(3)A.单位时间内生成1mol NO2的同时消耗了lmol NO,都是正反应,故不能说明达到平衡状态,故A错误;
B.密度=$\frac{总质量}{体积}$,总质量一定,体积一定,故密度一定,故混合气体的密质不再发生改变不能说明达到平衡状态,故B错误;
C.混合气体的平均相对分子质量不再改变,说明物质的量不变,能说明达到平衡状态,故C正确;
D.在恒温恒压的容器中,NO的体积分数保持不变,则反应达平衡,能说明达到平衡状态,故D正确;
故选:CD;
(4)因为该反应为气体体积减小的放热反应,即△H<0,△S<0,所以在高温下△G=△H-T△S>0非自发,
故答案为:因为该反应为气体体积减小的放热反应,即△H<0,△S<0;
(5)根据图象分析,常压下NO的转化率已经较高,并且高压转化率增加不大,但增加成本较大,故答案为:常压下NO的转化率已经较高,并且高压要增加成本;
(6)①温度一定,随反应物NO、CO的起始物质的量比增大,X-Y反应正向进行,一氧化碳的转化率X<Y,Y-Z平衡正向进行,一氧化氮增大会提高一氧化碳的转化率,则Y<Z,X、Y、Z三点,CO的转化率的从大到小的顺序Z>Y>X,
故答案为:Z>Y>X;
②根据图象1分析,温度越低NO的平衡转化率越大,说明该反应为放热反应,所以温度越低,平衡时二氧化碳的体积分数也越大,又T2<T1,所以温度为T2时的变化趋势曲线为: ,故答案为:
,故答案为: .
.
点评 本题考查了盖斯定律计算,化学反应速率、平衡常数概念理解和计算应用,图象分析方法,反应自发进行的判断依据是关键,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 为了使婴儿对食品有更浓厚的兴趣,应在婴儿食品中加入大量的着色剂 | |
| B. | 为了使火腿肠颜色更鲜红,可多加入一些亚硝酸钠 | |
| C. | 蛋白质属于酸性食物 | |
| D. | 常用的抗酸药有氢氧化钠、氢氧化铝、碳酸钙等 |
| A. | 要证明硫酸亚铁铵晶体中含有NH4+,可以取少量晶体溶于水,加入足量NaOH浓溶液并加热,再用湿润的蓝色石蕊试纸检验产生的气体 | |
| B. | KClO3、KNO3、KMnO4等强氧化剂或其混合物不能研磨,否则将引起爆炸 | |
| C. | 常温下用pH试纸分别测定0.1mol•L-1NaClO溶液和0.01mol•L-1NaClO溶液的pH,可以比较浓度对水解程度的影响 | |
| D. | 过滤、结晶、灼烧、萃取、分液和蒸馏等都是常用的分离有机混合物的方法 |
| A. | 由乙烯、氢气制取乙烷,由乙烷、溴(气体)制溴乙烷 | |
| B. | 乙烯使溴水褪色,乙炔使酸性高锰酸钾水溶液褪色 | |
| C. | 乙醇、乙酸制乙酸乙酯,由甘氨酸制得二肽 | |
| D. | 由乙烯制取聚乙烯,由甲醛、苯酚制取酚醛树脂 |
| A. | 该反应的焓变为正值 | |
| B. | 恒温恒容下,充入N2,平衡不移动 | |
| C. | 升高温度,逆反应速率增大 | |
| D. | 该反应化学方程式为CO+H2O$?_{高温}^{催化剂}$CO2+H2 |
| a | |||||||
| d | f | g | |||||
| b | c | e | h | ||||
(1)g与b可形成离子化合物b2g,试写出它的电子式
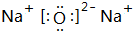 .
.(2)e、f、g 三种元素气态氢化物的稳定性由弱到强的顺序为(用化学式表示)SiH4<NH3<H2O.
(3)在1L的密闭容器中,通入1mol f2气体和3mol a2气体,一定温度下反应生成fa3气体,2min时,测得f2的浓度为0.75mol•L-1,则2min时fa3的物质的量为0.5mol,a2的化学反应速率v(a2)=0.375 mol•(L•min)-1.
(4)a、d两种元素可形成多种化合物,其中化合物X是最简单的有机物,已知常温下4g X在O2中完全燃烧放出222.4KJ的热量,试写出化合物X完全燃烧的热化学方程式:CH4(g)+2O2(g)→CO2(g)+2H2O(1)H=-889.6kJ/mol.
(5)航天技术中常使用a和g单质组成的碱性燃料电池,该电池具有高能、轻便和不污染环境等优点.该电池正极电极反应式为O2+2H2O+4e-=4OH-.
| A. | 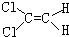 | B. | 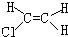 | C. | 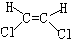 | D. | 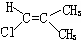 |
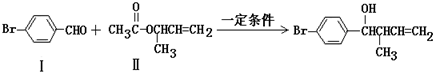

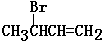 .
.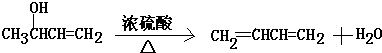 (注明反应条件).在碱性条件下,由Ⅳ与
(注明反应条件).在碱性条件下,由Ⅳ与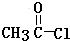 反应合成Ⅱ,其反应类型为取代反应.
反应合成Ⅱ,其反应类型为取代反应.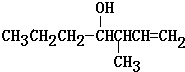 (写出其中一种).
(写出其中一种).