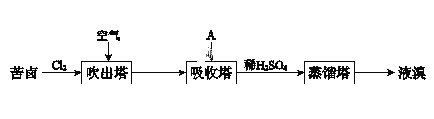
题目内容
【题目】为了验证浓硫酸和木炭粉在加热条件下产生的产物,某同学选用了如图所示的实验装置。下列说法错误的是( )

A.B装置用来检验产物中是否有水蒸气生成
B.C装置用来检验产物中是否有SO2生成
C.F装置用来检验产物中是否有CO2生成
D.将装置B与C位置互换,仍可以达到实验目的
【答案】D
【解析】
A. 若反应产生了H2O,无水硫酸铜与水结合形成CuSO4·5H2O,物质的颜色由白色变为蓝色,A正确;
B. SO2气体具有漂白性,能够使品红溶液褪色,因此可用来检验产物中是否有SO2生成,B正确;
C. 反应产生的SO2在D中与溴水发生反应: Br2+SO2+2H2O=H2SO4+2HBr,经E中品红溶液检验不褪色,说明SO2已经除尽,然后在F中发生反应:CO2+Ca(OH)2=CaCO3↓+H2O,看到石灰水变浑浊,可以证明反应产生CO2,C正确;
D. 若将装置B与C位置互换,由于气体通过品红溶液会带出一部分水,因此不能达到检验水蒸气的产生,因此不能达到实验目的,D错误;
故合理选项是D。

 名校课堂系列答案
名校课堂系列答案【题目】PH3是粮食杀虫处理时常用的熏蒸杀虫剂;水煤气变换时产生的PH3能使催化剂中毒,必须脱除。回答下列问题:
(1)PH3通入NaClO溶液脱除PH3时,氧化产物是一种含氧酸且反应中氧化剂与还原剂的物质的量之比为4:1,则该含氧酸的化学式为______。
(2)已知下列键能数据及P4(白磷)分子结构:
化学键 | P-P | H-H | P-H |
|
键能/(kJmol-1) | 213 | 436 | 322 |
则反应4PH3(g)P4(g)+6H2(g)△H=______kJmol-1;某温度时平衡体系中c(PH3)=0.25molL-1,c(H2)=c(P4)=0.50molL-1,则平衡常数K=______。
(3)文献报道“反应6.25CO2(g)+Fe3O4(s)+3PH3(g)=3FePO4(s)+4.5H2O(g)+6.25C(s)”是铁触媒中毒的主导反应,其平衡常数Kp(Kp为以分压表示的平衡常数)的对数值与温度的关系如图所示:
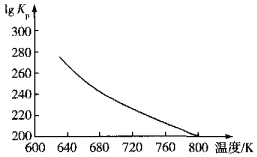
①该反应的△H______0(填“>”“<”或“=”)。
②图中lgKp=______[列出用分压p(CO2)、p(PH3)、p(H2O)表示的计算式]。
(4)反应(CH3)3AuPH3→(CH3)AuPH3+C2H6的历程如下:
第一步:(CH3)3AuPH3![]() (CH3)3Au+PH3(快反应)
(CH3)3Au+PH3(快反应)
第二步:(CH3)3Au![]() C2H6+CH3Au(慢反应)
C2H6+CH3Au(慢反应)
第三步:CH3Au+PH3![]() (CH3)AuPH3(快反应)
(CH3)AuPH3(快反应)
①反应的中间产物有PH3、______。
②第______步(填“一”“二”或“三”)反应的活化能最大。
(5)用Cu2+、Pd2+液相脱除PH3的反应为:PH3+2O2 H3PO4,其他条件相同时溶解在溶液中O2的体积分数、PH3的净化效率与时间的关系如图所示:
H3PO4,其他条件相同时溶解在溶液中O2的体积分数、PH3的净化效率与时间的关系如图所示:
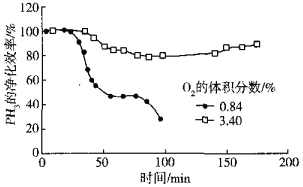
O2的体积分数大,PH3的净化效率高的原因是______(用碰撞理论等说明)。