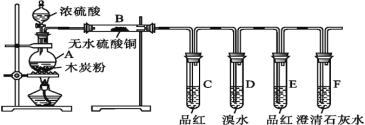
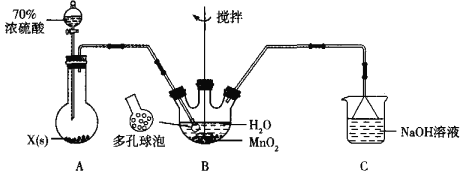
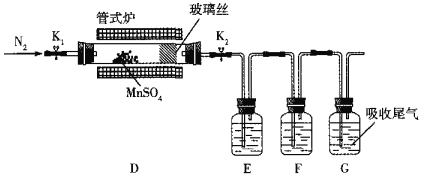
题目内容
【题目】以Fe3+/Fe2+作为氧化还原介质,可以在低电位条件下电解HCl制取Cl2,其原理如图所示,下列说法正确的是( )
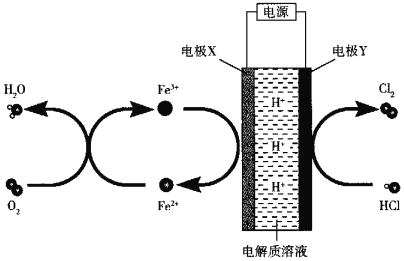
A.X极上的电势比Y极上的低
B.![]() 向Y极迁移,X极周围溶液pH升髙
向Y极迁移,X极周围溶液pH升髙
C.X极上发生反应:![]()
D.电解总反应为![]()
【答案】A
【解析】
A、根据装置图中Y电极上HCl失去电子、被氧化生成Cl2可知,Y电极为电解池的阳极,与电源正极相接,则电极X为电解池的阴极,与电源负极相接,所以Y极上的电势比X极上的高,故A正确;
B、Y电极为电解池的阳极,电极X为电解池的阴极,阳离子H+向X极迁移,X极周围溶液酸性增强、pH减小,故B错误;
C、由图可知,阴极X电极发生得电子的还原反应、电极反应式为Fe3++e-=Fe2+,故C错误;
D、电解时,阳极上反应式为2HCl-2e-=2H++Cl2↑,阴极上反应式为Fe3++e-=Fe2+,生成的Fe2+与O2反应生成Fe3+、循环转化的方程式为4Fe2++O2+4H+=4Fe3++2H2O,所以电解总反应为4HCl+O2=2Cl2+2H2O,故D错误;
答案选A。

【题目】用生产钛白的副产品FeSO4与软锰矿(主要成分是MnO2)可制备高纯MnO2
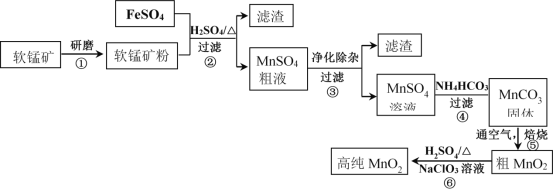
(1)步骤①中研磨的目的是______________________。
(2)步骤②中主要发生的反应是FeSO4与MnO2转化为MnSO4与__________。
(3)步骤②中Mn2+浸出率受初始H2SO4浓度与温度的影响如下图所示。
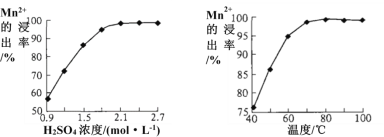
软锰矿粉酸浸的适宜条件是________________。
(4)步骤②中,若硫酸初始浓度小于1.8mol/L,反应进行一段时间后,有红褐色固体析出,其原因是____________。
(5)已知MnSO4粗液中还含有Al3+、Fe3+和Ni2+离子,溶液中离子生成氢氧化物的pH如下表:
Al(OH)3 | Fe(OH)3 | Ni(OH)2 | Mn(OH)2 | |
开始沉淀时pH | 3.4 | 1.5 | 6.9 | 8.2 |
完全沉淀时pH | 4.7 | 2.8 | 8.9 | 10.2 |
注:金属离子的起始浓度为0.1mol·L-1
步骤③进行的操作是:调节pH=5.4,过滤,滤渣中含_____________________。
(6)已知:几种难溶物的溶解平衡常数K
化学式 | MnCO3 | NiCO3 | MnS | NiS |
K | 2.24×10-11 | 1.42×10-7 | 4.65×10-14 | 1.07×10-21 |
步骤③还需加入的除杂试剂是_______固体(填序号)。
A.Na2CO3 B.MnCO3 C.Na2S D.MnS
(7)步骤⑤中焙烧MnCO3制MnO2,发生反应的化学方程式是_____________。