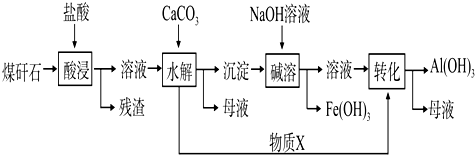
题目内容
2.在一密闭的容器里装有氮气和氢气,反应开始时,氮气的浓度为2 mol•L-1,氢气的浓度为5 mol•L-1,反应开始2 min时,测得容器中氮气的浓度为1.8 mol•L-1.这2 min内氮气的平均反应速率是多少?氢气和氨气的平均反应速率各是多少?分析 依据v(N2)=$\frac{c({N}_{2})}{△t}$计算2min内氮气的平均反应速率,然后利用各种物质的反应速率之比等于其化学计量数之比计算氢气和氨气的平均反应速率即可.
解答 解:v(N2)=$\frac{c({N}_{2})}{△t}$=$\frac{2mol/L-1.8mol/L}{2min}$=0.1mol•L-1•min-1,由于发生反应:N2+3H2=2NH3,故v(N2):v(H2):v(NH3)=1:3:2,故v(H2)=3×v(N2)=0.31mol•L-1•min-1,v(NH3)=2×v(N2)=0.2mol•L-1•min-1,
答:2 min内氮气的平均反应速率是0.1mol•L-1•min-1;氢气和氨气的平均反应速率各是0.3mol•L-1•min-1、0.2mol•L-1•min-1.
点评 本题主要考查的是化学反应速率的计算,题目难度不大,本题注意分析化学方程式的特征,根据化学计量数之比等于其化学反应速率之比求解是关键.

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
12.磷酸分子间脱水会形成多种聚磷酸,它们的钠盐是广泛使用的食品添加剂.将48gNaOH与58.8g固态纯H3PO4在一定温度下加热,得到79.8g固体A和27g水,则A可能是( )
| A. | Na3PO4 | B. | Na4P2O7 | ||
| C. | Na4P2O7 和Na5P3O10 | D. | Na3PO4、Na4P2O7和Na5P3O10 |
10.如图为周期表的一部分,所有元素都是主族元素,不正确的是( )
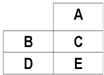

| A. | E的核电荷数大于B | |
| B. | A、C若为非金属,则对应氢化物的稳定性:A>C | |
| C. | B、D若为金属,其最高价氧化物对应水化物碱性:D>B | |
| D. | A一定是非金属元素 |
7.自来水厂生产自来水的工艺流程示意图如图所示

“加氯”是指加入含有氯元素的物质,该物质可以是( )

“加氯”是指加入含有氯元素的物质,该物质可以是( )
| A. | 氯气 | B. | ClO2 | C. | NaCl | D. | NaClO3 |
8.给3mL液体加热,需使用的仪器有( )
①试管 ②烧杯 ③试管夹 ④酒精灯⑤蒸发皿 ⑥石棉网 ⑦铁架台(带铁圈)
①试管 ②烧杯 ③试管夹 ④酒精灯⑤蒸发皿 ⑥石棉网 ⑦铁架台(带铁圈)
| A. | ①③④⑤ | B. | ②④⑥ | C. | ①③④ | D. | ②④⑥⑦ |