题目内容
【题目】FeBr2是一种黄绿色固体,某学习小组制备并探究它的还原性
Ⅰ.实验室制备FeBr2
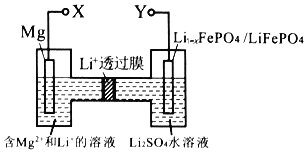
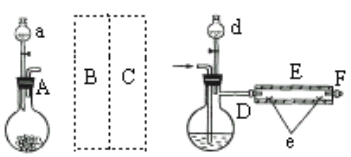
实验室用下图所示装置制取溴化亚铁.其中A为CO2发生装置,D和d中均盛有液溴,E为外套电炉丝的不锈钢管,e是两个耐高温的瓷皿,其中盛有细铁粉。
实验开始时先将铁粉加热至600℃~700℃,然后将干燥、纯净的CO2气流通入D中,E管中反应开始,不断将d中液溴滴入100℃~120℃的D中,经过几小时的连续反应,在铁管的一端沉积有黄绿色鳞片状溴化亚铁。
请回答:
(1)若在A中盛固体CaCO3,a中盛6mol/L盐酸,B处是装有饱和NaHCO3溶液的洗气瓶为使导入D中的CO2为干燥纯净的气体,则图中C处的装置和其中的试剂应是:________,为防止污染空气,实验时应在F处连接盛________的尾气吸收装置。
(2)反应过程中要不断通入CO2,其主要作用有两个:①是利用CO2把反应器中空气赶尽;②是________.
Ⅱ.探究FeBr2的还原性
(1)实验需要90 mL 0.1 mol·L-1FeBr2溶液,配制FeBr2溶液除烧杯、量筒、胶头滴管、玻璃棒外还需的玻璃仪器是________。
(2)取10mL上述FeBr2溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设:
假设1:Br-被Cl2氧化成Br2溶解在溶液中;
假设2:Fe2+被Cl2氧化成Fe3+。
设计实验证明假设2是正确的_______________________________
(3)实验证明:还原性Fe2+>Br-请用一个离子方程式来证明:_____________;
(4)若在40mL上述FeBr2溶液中通入3×10-3molCl2,则反应的离子方程式为:____________。
【答案】浓H2SO4的洗气瓶 NaOH溶液 将Br2蒸气带入反应管中 100 mL容量瓶 向黄色溶液中加入少量KSCN溶液,若溶液变血红色,则证明假设2正确 Fe2++Br2=2Fe3++2Br- 4Fe2++2Br-+3Cl2=4Fe3++Br2+6Cl-
【解析】
I. (1)装置B用于除去CO2中的HCl气体;装置D作用是干燥CO2气体,根据Br2的性质选择合适的尾气处理试剂;
(2)通入CO2,可以将容器中的空气赶净;将Br2蒸气带入反应器D中;
II.(1)根据选择仪器的标准和配制一定体积、一定物质的量浓度的溶液的步骤选择合适的仪器;
(2)Fe2+被Cl2氧化成Fe3+ ,可向该溶液中加入KSCN溶液来检验是否含有Fe3+;
(3)根据还原剂的还原性大于还原产物,只要在含有Fe2+的溶液中滴加溴水即可;
(4) 40mL0.1mol/LFeBr2溶液中溶质的物质的量是0.004mol ,通入3×10-3molC12,二者的物质的量比为4:3反应,结合还原性Fe2+>Br-,由氧化还原反应的先后规律和电子守恒可知:亚铁离子全部被氧化,溴离子只有四分子之一被氧化。
I. ( 1 )装置B用于除去CO2中的HCl杂质气体,可以用盛有NaHCO3饱和溶液的洗气瓶洗气;装置D作用是干燥CO2,可以用盛有浓H2SO4的洗气瓶干燥;Br2会导致大气污染,可根据Br2与NaOH溶液作用产生可溶性的物质的性质,用NaOH溶液作尾气吸收试剂。
(2)反应过程中要不断地通入CO2,其主要作用是:①反应前将容器中的空气赶净,避免空气中的氧气干扰实验;②反应过程中要不断通入CO2,还可以将Br2蒸气带入反应器D中,使溴能够与铁粉充分反应;
II.(1)配制一定体积、一定物质的量浓度的溶液需要的仪器有天平、药匙、烧杯、玻璃棒、一定规格的容量瓶、 胶头滴管,实验室没有90mL容量瓶,根据选择仪器的标准“大而近”的原则,要使用100mL的容量瓶;
(2)取适量黄色溶液,向其中加入少量KSCN溶液,若溶液变血红色,可证明溶液中含有Fe3+离子,从而证明假设2正确;
(3)利用还原剂的还原性大于还原产物,则可在含有Fe2+的溶液中滴加溴水,会发生离子反应Br2+2Fe2+=2Fe3++2Br-,即可证明还原性Fe2+>Br-;
(4)40mL0.1mol/LFeBr2溶液中溶质的物质的量是0.004mol ,通入3×10-3molC12,二者的物质的量比为4:3反应,结合还原性Fe2+>Br-,由氧化还原反应的先后规律和电子守恒可知,亚铁离子全部被氧化,溴离子只有四分子之一被氧化 ,发生反应的离子方程式为4Fe2+ +2Br-+3Cl2=4Fe3++Br2+6Cl-。

 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案【题目】化学变化是有条件的。某小组同学探究I-与金属阳离子的氧化还原反应,实验过程如下。已知同浓度的稀溶液中氧化性:Ag+>Fe3+>Cu2+。
实狯 | 现象 | ||
| 编号 | 溶液x | |
I | 0.1mol/LFe(NO3)2,pH≈l | 溶液黄色立即加深,30秒后溶液变为褐色,无浑浊 | |
Ⅱ | KNO3和HNO3,其中c(NO3-)=0.3mol/L,pH≈1 | 1小时内溶液颜色始终保持无色 | |
Ⅲ | 0.1mol/LAgNO3 | 迅速变浑浊,离心分离后上层溶液为无色(经检测无I2),固体为黄色(AgI) | |
IV | 0.1mol/LCu(NO3)2 | 5秒后溶液由浅蓝色变为黄色并产生浑浊,离心分离后上层溶液为黄色(经检测有I2),固体为白色(CuI) | |
(1)根据实验I和Ⅱ,请回答下列问题。
①由“黄色立即加深”初步判断有I2生成,选择___(填试剂)进一步证实生成了I2。
②写出Fe3+与I-反应的离子方程式___,该条件下氧化性:Fe3+___I2(选填“>”或“<”)。
③实验Ⅱ的目的是___。
(2)实验Ⅳ中Cu2+与I-反应的离子方程式是___,甲同学得出氧化性:Cu2+>I2。
(3)乙同学认为甲同学的结论不合理,分析原因:实验Ⅲ应有I2生成,但却生成了AgI沉淀,因此推测实验Ⅳ中I2的生成,与CuI沉淀有关,故不能确定氧化性:Cu2+>I2,并用如图装置进行验证。K闭合后,较长时间发现两侧溶液均无明显变化。乙同学为了进一步判断Cu2+和I2的氧化性强弱,将左侧电极改为Cu电极,并向右侧溶液中加入少量___(填试剂),发现指针偏转,且左侧溶液颜色加深,证明该条件下氧化性:Cu2+___I2(选填“>”或“<”)。

(4)该小组同学进一步分析认为,实验Ⅲ没有发生2Ag++2I-=2Ag+I2的反应,原因是生成AgI沉淀,反应物浓度迅速降低,不利于该反应进行;请分析实验Ⅳ发生氧化还原反应的原因是___。
(5)小组同学反思实验,反应体系中,各物质浓度对氧化还原反应是否发生都有一定的影响。