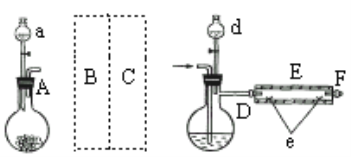
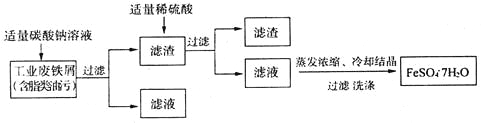
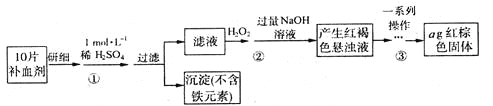
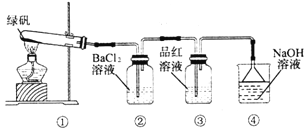
题目内容
【题目】在由水电离出的c(H+)=1×10-12molL-1的溶液中,一定能大量共存的离子组是( )
A.NH![]() 、Ba2+、NO
、Ba2+、NO![]() 、Cl-B.Cl-、SO
、Cl-B.Cl-、SO![]() 、Na+、K+
、Na+、K+
C.SO![]() 、NO
、NO![]() 、Fe2+、Mg2+D.Na+、K+、ClO-、I-
、Fe2+、Mg2+D.Na+、K+、ClO-、I-
【答案】B
【解析】
由水电离出的c(H+)=1×1012molL1的溶液,水的电离受到抑制,溶液可能为酸或碱的溶液;再根据离子之间不能结合生成沉淀、气体、水、弱电解质,不能发生氧化还原反应等,才能大量共存,以此来解答。
A.NH![]() 在碱性条件下生成一水合氨,不能大量共存,故A不符合题意;
在碱性条件下生成一水合氨,不能大量共存,故A不符合题意;
B.酸或碱溶液中,四种离子之间不发生反应,可以大量共存,故B符合题意;
C.碱性溶液中Fe2+、Mg2+与氢氧根离子反应不能大量共存;酸性溶液中NO![]() 、Fe2+发生氧化还原反应不能大量共存,故C不符合题意;
、Fe2+发生氧化还原反应不能大量共存,故C不符合题意;
D.酸性条件下ClO-、I-能发生氧化还原反应不能大量共存,故D不符合题意;
故选:B。

 阅读快车系列答案
阅读快车系列答案【题目】A、B、C、D、E是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下:
元素 | 相关信息 |
A | 基态原子的价电子排布式为nSnnPn |
B | 元素原子的核外p电子数比s电子数少1个 |
C | 最外层电子数是电子层数的3倍 |
D | 简单离子是第三周期元素中离子半径最小的 |
E | 价电子层中的未成对电子数为4 |
请回答下列问题:
(1)写出下列元素的名称:A______, B_______, C________,D__________
(2)写出C元素在周期表的位置_________,E2+价电子的轨道表示式________________,B元素能量最高的电子为_____轨道上的电子,其轨道呈_______形.
(3)按原子轨道的重叠方式,1molA与C形成的最高价化合物中σ键有______个,π键有______个。
(4)B、C、D的简单离子的半径由大到小的顺序为_____________(用离子符号表示)。
(5)写出C的核外有18个电子的氢化物的电子式_____________。