题目内容
【题目】化学变化是有条件的。某小组同学探究I-与金属阳离子的氧化还原反应,实验过程如下。已知同浓度的稀溶液中氧化性:Ag+>Fe3+>Cu2+。
实狯 | 现象 | ||
| 编号 | 溶液x | |
I | 0.1mol/LFe(NO3)2,pH≈l | 溶液黄色立即加深,30秒后溶液变为褐色,无浑浊 | |
Ⅱ | KNO3和HNO3,其中c(NO3-)=0.3mol/L,pH≈1 | 1小时内溶液颜色始终保持无色 | |
Ⅲ | 0.1mol/LAgNO3 | 迅速变浑浊,离心分离后上层溶液为无色(经检测无I2),固体为黄色(AgI) | |
IV | 0.1mol/LCu(NO3)2 | 5秒后溶液由浅蓝色变为黄色并产生浑浊,离心分离后上层溶液为黄色(经检测有I2),固体为白色(CuI) | |
(1)根据实验I和Ⅱ,请回答下列问题。
①由“黄色立即加深”初步判断有I2生成,选择___(填试剂)进一步证实生成了I2。
②写出Fe3+与I-反应的离子方程式___,该条件下氧化性:Fe3+___I2(选填“>”或“<”)。
③实验Ⅱ的目的是___。
(2)实验Ⅳ中Cu2+与I-反应的离子方程式是___,甲同学得出氧化性:Cu2+>I2。
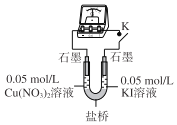
(3)乙同学认为甲同学的结论不合理,分析原因:实验Ⅲ应有I2生成,但却生成了AgI沉淀,因此推测实验Ⅳ中I2的生成,与CuI沉淀有关,故不能确定氧化性:Cu2+>I2,并用如图装置进行验证。K闭合后,较长时间发现两侧溶液均无明显变化。乙同学为了进一步判断Cu2+和I2的氧化性强弱,将左侧电极改为Cu电极,并向右侧溶液中加入少量___(填试剂),发现指针偏转,且左侧溶液颜色加深,证明该条件下氧化性:Cu2+___I2(选填“>”或“<”)。
(4)该小组同学进一步分析认为,实验Ⅲ没有发生2Ag++2I-=2Ag+I2的反应,原因是生成AgI沉淀,反应物浓度迅速降低,不利于该反应进行;请分析实验Ⅳ发生氧化还原反应的原因是___。
(5)小组同学反思实验,反应体系中,各物质浓度对氧化还原反应是否发生都有一定的影响。
【答案】淀粉溶液或者四氯化碳 2Fe3++2I-2Fe2++I2 作对比实验,排除了实验条件下I2不是NO3-或水中溶解的O2氧化得到 > 2Cu2++4I-=2CuI↓+I2 I2 < 发生2Cu2++2I-2Cu++I2,由于Cu+与I-生成CuI沉淀,使产物浓度降低,平衡移动,促进反应进行
【解析】
(1)①碘单质遇到淀粉变蓝色,有机溶剂也能萃取碘呈现特殊颜色;
②Fe3+与I-反应生成碘单质和亚铁离子,氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性;
③作对照实验,排除实验条件下I2不是NO3-或水中溶解的O2氧化得到;
(2)实验IV中,通过实验现象知,Cu2+与I-反应有CuI和碘单质生成,说明二者发生氧化还原反应;
(3)图为具有盐桥的原电池较长时间发现两侧溶液均无明显变化,说明Cu2+不能氧化I-。将左侧电极改为Cu电极,进一步判断Cu2+和I2的氧化性强弱,左侧溶液颜色加深,说明发生转化Cu→Cu2+右侧发生还原反应,即I2![]() I-;
I-;
(4)反应IV发生:2Cu2++2I-=2Cu++I2沉淀促进平衡移动;
(5)反应体系中各物质浓度对氧化还原反应发生都有一定的影响。
(1) ①由“黄色立即加深”初步判断有![]() 生成,选择淀粉溶液或者四氯化碳进一步证实生成了
生成,选择淀粉溶液或者四氯化碳进一步证实生成了![]() ,故答案为:淀粉溶液或者四氯化碳;
,故答案为:淀粉溶液或者四氯化碳;
![]() 与
与![]() 反应生成碘单质和亚铁离子,反应离子方程式为:
反应生成碘单质和亚铁离子,反应离子方程式为:![]() ,故氧化性:
,故氧化性:![]() ,故答案为:
,故答案为:![]() ;
;![]() ;
;
![]() 实验II中没有
实验II中没有![]() 生成,说明实验条件下
生成,说明实验条件下![]() 不是
不是![]() 或水中溶解的
或水中溶解的![]() 氧化得到,排除
氧化得到,排除![]() 或水中溶解的
或水中溶解的![]() 的干扰,故答案为:作对比实验,排除了实验条件下
的干扰,故答案为:作对比实验,排除了实验条件下![]() 不是
不是![]() 或水中溶解的
或水中溶解的![]() 氧化得到;
氧化得到;
(2)实验IV中,通过实验现象知,![]() 与
与![]() 反应有CuI和碘单质生成,说明二者发生氧化还原反应,反应离子方程式为:
反应有CuI和碘单质生成,说明二者发生氧化还原反应,反应离子方程式为: ![]() ,故答案为:
,故答案为: ![]() ;
;
(3)图为具有盐桥的原电池,较长时间发现两侧溶液均无明显变化,说明![]() 不能氧化
不能氧化![]() ,将左侧电极改为Cu电极电极发生偏转,左侧溶液颜色加深,说明发生转化
,将左侧电极改为Cu电极电极发生偏转,左侧溶液颜色加深,说明发生转化![]() ,右侧发生还原反应,向右侧溶液中加入少量
,右侧发生还原反应,向右侧溶液中加入少量![]() ,发生转化
,发生转化![]() ,说明氧化性明该条件下氧化性:
,说明氧化性明该条件下氧化性:![]() ,故答案为:
,故答案为:![]() ;
;![]() ;
;
(4)反应IV发生:![]() ,由于
,由于![]() 与
与![]() 生成CuI沉淀,使产物浓度降低,平衡移动,促进反应进行,故答案为:发生
生成CuI沉淀,使产物浓度降低,平衡移动,促进反应进行,故答案为:发生![]() ,由于
,由于![]() 与
与![]() 生成CuI沉淀,使产物浓度降低,平衡移动,促进反应进行;
生成CuI沉淀,使产物浓度降低,平衡移动,促进反应进行;

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案【题目】A、B、C、D、E是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下:
元素 | 相关信息 |
A | 基态原子的价电子排布式为nSnnPn |
B | 元素原子的核外p电子数比s电子数少1个 |
C | 最外层电子数是电子层数的3倍 |
D | 简单离子是第三周期元素中离子半径最小的 |
E | 价电子层中的未成对电子数为4 |
请回答下列问题:
(1)写出下列元素的名称:A______, B_______, C________,D__________
(2)写出C元素在周期表的位置_________,E2+价电子的轨道表示式________________,B元素能量最高的电子为_____轨道上的电子,其轨道呈_______形.
(3)按原子轨道的重叠方式,1molA与C形成的最高价化合物中σ键有______个,π键有______个。
(4)B、C、D的简单离子的半径由大到小的顺序为_____________(用离子符号表示)。
(5)写出C的核外有18个电子的氢化物的电子式_____________。