题目内容
【题目】根据所学物质结构知识,请你回答下列问题:
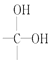
(1)已知氮元素是植物生长所需的元素,常见氮肥有铵盐(![]() )、尿素
)、尿素![]() 等
等
①尿素分子中四种元素的电负性由大到小顺序是_______________。
②![]() 中H—N—H键角比NH3中H—N—H键角大,原因为_______________。
中H—N—H键角比NH3中H—N—H键角大,原因为_______________。
(2)[Zn(CN)4]2-在水溶液中与HCHO发生如下反应:
4HCHO+[Zn(CN)4]2-+4H++4H2O===[Zn(H2O)4]2++4HOCH2CN
①Zn2+基态核外电子排布式为___________________。
②与H2O分子互为等电子体的阴离子为________。
③[Zn(CN)4]2-中Zn2+与CN-的C原子形成配位键。不考虑空间构型,[Zn(CN)4]2-的结构可用示意图表示为_____________________。
(3)根据对角线规则,铍(Be)与铝性质相似。
①以下对铍及其化合物的推断肯定不正确的是_______________(选填序号)。
a.常温下铍会在浓硫酸中钝化 b.氯化铍是共价化合物
c.氧化铍坚硬难熔 d.氢氧化铍是强碱
②写出BeCl2溶液和Na2BeO2溶液混合后反应的离子方程式_______________。
(4)FeCl3中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的FeCl3的结构式为________,其中Fe的配位数为_____________。
【答案】O>N>C>H NH3分子中存在一对孤电子对,孤电子对对成键电子对的排斥力大于成键电子对对成键电子对的排斥力(其他合理也行)。 1s22s22p63s23p63d10(或[Ar]3d10) NH2- 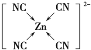 d Be2++BeO22-+2H2O==2Be(OH)2↓
d Be2++BeO22-+2H2O==2Be(OH)2↓ ![]() 4
4
【解析】
(1)①由尿素分子结构式判断四种元素的电负性大小,属基础题;
②NH3中N原子上有一对孤对电子,NH3中孤电子对与成键电子对排斥力较大,使键角变小;
(2)①Zn 的原子序数为30,故Zn2+基态核外电子排布式为1s22s22p63s23p63d10;
②等电子体是指化学通式相同且价电子总数相同的分子或离子,等电子体具有相同的空间构型和化学键类型;
③[Zn(CN)4]2-中Zn2+与CN-的C原子形成配位键, [Zn(CN)4]2-的结构可用示意图表示为 ;
;
(3)根据对角线规则,铍(Be)与铝性质相似。可据此解答问题;
(4)FeCl3中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的FeCl3的结构式为![]() ,本题考查的是配位键的形成。
,本题考查的是配位键的形成。
(1)①由尿素分子结构式![]() 可知,四种元素为H、C、N、O,故四种元素的电负性由大到小顺序是O>N>C>H,答案为:O>N>C>H;
可知,四种元素为H、C、N、O,故四种元素的电负性由大到小顺序是O>N>C>H,答案为:O>N>C>H;
②![]() 中N原子没有孤对电子,而NH3中N原子上有一对孤对电子,NH3中孤电子对与成键电子对排斥力较大,使键角变小,即
中N原子没有孤对电子,而NH3中N原子上有一对孤对电子,NH3中孤电子对与成键电子对排斥力较大,使键角变小,即![]() 中H—N—H键角比NH3中H—N—H键角大。故答案为:NH3分子中存在一对孤电子对,孤电子对对成键电子对的排斥力大于成键电子对对成键电子对的排斥力;
中H—N—H键角比NH3中H—N—H键角大。故答案为:NH3分子中存在一对孤电子对,孤电子对对成键电子对的排斥力大于成键电子对对成键电子对的排斥力;
(2)①Zn 的原子序数为30,Zn基态核外电子排布式为1s22s22p63s23p63d104s2,故Zn2+基态核外电子排布式为1s22s22p63s23p63d10;故答案为:1s22s22p63s23p63d10 ;
②等电子体是指化学通式相同且价电子总数相同的分子或离子,等电子体具有相同的空间构型和化学键类型,与H2O分子互为等电子体的阴离子为NH2-,故答案为:NH2-;
③[Zn(CN)4]2-中Zn2+与CN-的C原子形成配位键。Zn2+提供空轨道,CN-中C提供孤对电子,不考虑空间构型,[Zn(CN)4]2-的结构可用示意图表示为 ,故答案为:
,故答案为: ;
;
(3)根据对角线规则,铍(Be)与铝性质相似。
①a.常温下铝会在浓硫酸中钝化,故常温下铍也会在浓硫酸中钝化,a正确;
b.氯化铝是共价化合物,故氯化铍也是共价化合物,b正确;
c.氧化铝熔点高,坚硬难熔,故氧化铍坚硬难熔,c正确;
d.氢氧化铝是弱碱,故氢氧化铍是弱碱,d错误;
故本题答案为d;
②BeCl2溶液和Na2BeO2溶液混合后反应后生成Be(OH)2沉淀,其反应的离子方程式为:Be2++BeO22-+2H2O==2Be(OH)2↓,故答案为:Be2++BeO22-+2H2O==2Be(OH)2↓; (4)FeCl3中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的FeCl3的结构式为![]() ,其中Cl提供孤对电子,Fe提供空轨道形成配位键;由结构式可知Fe的配位数为4,故答案为:
,其中Cl提供孤对电子,Fe提供空轨道形成配位键;由结构式可知Fe的配位数为4,故答案为:![]() ,4;
,4;

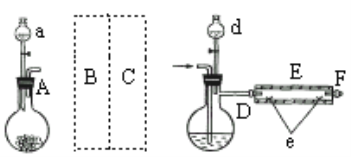
【题目】某校化学研究性学习小组设计实验验证NH3能还原CuO,并对还原产物进行探究。请回答下列问题:
Ⅰ.验证NH3能还原CuO

(1)试剂X为___________________________。
(2)请将提供的装置按合理顺序连接。g→_______________________。
(3)装置B的作用是_______________________。
(4)证明NH3能还原CuO的实验现象是_______________________。
II.探充还原产物的成分
【查阅资料】Cu2O粉末呈红色,在酸性溶液中不稳定:Cu2O+H2SO4(稀)=Cu+CuSO4+H2O。
【实验探究】
实验操作 | 实验现象 | 实验结论 |
取10.4g红色固体于烧杯中,加入足量稀硫酸,充分搅拌,静置 | 若无现象 | ①证明红色固体为_________。 |
若溶液变蓝 | ②证明红色固体肯定含有______,可能含有__________。 | |
取上述反应后的混合物过滤、洗涤、干燥、称重,得固体6.4g | ③经计算,红色固体的成分及其物质的量__________ |
【题目】A、B、C、D、E是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下:
元素 | 相关信息 |
A | 基态原子的价电子排布式为nSnnPn |
B | 元素原子的核外p电子数比s电子数少1个 |
C | 最外层电子数是电子层数的3倍 |
D | 简单离子是第三周期元素中离子半径最小的 |
E | 价电子层中的未成对电子数为4 |
请回答下列问题:
(1)写出下列元素的名称:A______, B_______, C________,D__________
(2)写出C元素在周期表的位置_________,E2+价电子的轨道表示式________________,B元素能量最高的电子为_____轨道上的电子,其轨道呈_______形.
(3)按原子轨道的重叠方式,1molA与C形成的最高价化合物中σ键有______个,π键有______个。
(4)B、C、D的简单离子的半径由大到小的顺序为_____________(用离子符号表示)。
(5)写出C的核外有18个电子的氢化物的电子式_____________。