题目内容
9.已知Rn-离子的质量数为35,中子数为18,核外电子总数为18,则该离子是( )| A. | Cl- | B. | F - | C. | S2- | D. | Br |
分析 质量数为35,中子数为18,可知质子数为17,为Cl元素,核外电子总数为18,说明离子带一个负电荷,以此解答该题.
解答 解:质量数为35,中子数为18,可知质子数为35-18=17,为Cl元素,核外电子总数为18,说明离子带一个负电荷,应为Cl-,
故选A.
点评 本题考查质子数、核外电子数、离子电荷的关系以及质量数、质子数、中子数的关系,难度较小,掌握好相互之间的关系即可顺利解答.要理解、熟记相互间的关系.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
20.在透明溶液中能大量共存的是( )
| A. | K+、Cu2+、Na+、Cl- | B. | H+、Na+、NO3-、HCO3- | ||
| C. | Ba2+、H+、NO3-、SO42- | D. | Mg2+、Na+、OH-、SO42- |
14.下列实验方法或操作正确的是( )
| A. |  转移溶液 | B. |  制蒸馏水 | C. | 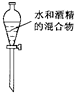 分离水和酒精 | D. | 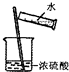 稀释浓硫酸 |
18.经测定乙烯溶解在乙醇中形成的溶液中,氧的质量分数为8%,则此溶液中氢的质量分数为( )
| A. | 75% | B. | 13.6% | C. | 14% | D. | 25% |
19.根据下列所给出的数据,得出的结论正确的是( )
| A. | 在10%的NaOH溶液中,平均每9个水分子溶有1个OHˉ | |
| B. | 将10g碳酸钙粉末加水配制成100mL溶液,CaCO3的物质的量浓度为1mol/L | |
| C. | 通入标准状况下11.2LHCl气体,可使1L 0.5mol/L的盐酸的物质的量浓度增大一倍 | |
| D. | 已知某氢氧化钠溶液中Na+与H2O的个数之比为1:a,则可求出此溶液中氢氧化钠的质量分数$\frac{20}{20+9a}$ |
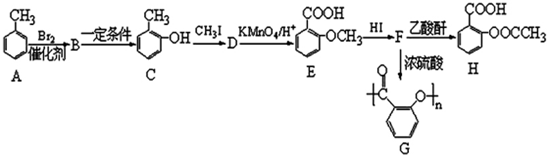
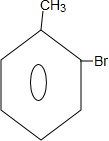 ;B→C的反应类型是取代反应.
;B→C的反应类型是取代反应.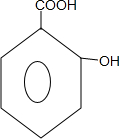 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$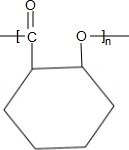 +nH2O.
+nH2O.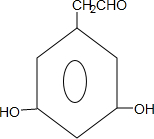 、
、 .
.