题目内容
10.分类是学习和研究化学的一种重要方法,下列分类合理的是( )| A. | Na2O和Na2O2都属于碱性氧化物 | B. | KOH和Na2CO3都属于碱 | ||
| C. | NaHSO4和HNO3都属于酸 | D. | Na2O和SiO2都属于氧化物 |
分析 A、碱性氧化物是能和酸反应生成盐和水的氧化物;
B、电离时生成的阴离子全部是氢氧根离子的化合物叫碱;
C、电离时生成的阳离子全部是氢离子化合物叫酸;
D、两种元素组成其中一种是氧元素的化合物.
解答 解:A、Na2O和酸反应生成盐和水,属于碱性氧化物,但是Na2O2和酸反应生成盐和水,还有氧气生成,不属于碱性氧化物,故A错误;
B、纯碱是碳酸钠的俗称,属于盐类,故B错误;
C、HNO3属于酸,但是NaHSO4属于盐,故C错误;
D、Na2O和SiO2都是两种元素组成,其中一种是氧元素的化合物,属于氧化物,故D正确.
故选D.
点评 本题考查了酸、碱、盐、氧化物的概念,难度不大,注意这几个概念的区别.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.在透明溶液中能大量共存的是( )
| A. | K+、Cu2+、Na+、Cl- | B. | H+、Na+、NO3-、HCO3- | ||
| C. | Ba2+、H+、NO3-、SO42- | D. | Mg2+、Na+、OH-、SO42- |
18.经测定乙烯溶解在乙醇中形成的溶液中,氧的质量分数为8%,则此溶液中氢的质量分数为( )
| A. | 75% | B. | 13.6% | C. | 14% | D. | 25% |
15.下列图示与对应的叙述不相符的是( )
| A. | 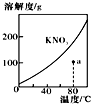 表示KNO3的溶解度曲线,a点所示的溶液是80℃时KNO3不饱和溶液 | |
| B. |  表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化 | |
| C. |  表示0.1000mol/LNaOH滴定20.00 mL 0.1000mol/L醋酸的滴定曲线 | |
| D. | 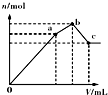 表示向NH4Al(SO4)2溶液中逐滴滴入Ba(OH)2溶液,体积V与沉淀n的变化 |
2.海洋中有丰富的食品、矿产、药物和水产等资源,下列有关说法正确的是( )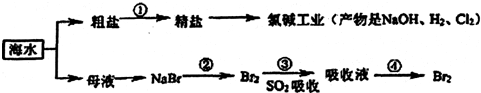

| A. | 海水淡化的主要方法有蒸馏法、电渗析法、离子交换法等 | |
| B. | 第①步中除去粗盐中可溶性杂质,可依次加入Na2CO3、Ba(OH)2、盐酸等试剂 | |
| C. | 在第②③④步中溴元素均被氧化 | |
| D. | 第④步涉及的分离操作有过滤、萃取、蒸馏 |
19.根据下列所给出的数据,得出的结论正确的是( )
| A. | 在10%的NaOH溶液中,平均每9个水分子溶有1个OHˉ | |
| B. | 将10g碳酸钙粉末加水配制成100mL溶液,CaCO3的物质的量浓度为1mol/L | |
| C. | 通入标准状况下11.2LHCl气体,可使1L 0.5mol/L的盐酸的物质的量浓度增大一倍 | |
| D. | 已知某氢氧化钠溶液中Na+与H2O的个数之比为1:a,则可求出此溶液中氢氧化钠的质量分数$\frac{20}{20+9a}$ |
20.下列叙述中,正确的是(NA代表阿伏加德罗常数)( )
| A. | 标准状况下,22.4L苯分子数为NA | |
| B. | 1mol•L-1FeCl3溶液中所含Cl-的数目为3NA | |
| C. | 25℃,1.01×105Pa,14g乙烯所含的碳原子数为NA | |
| D. | 1molNa2SO4溶于水,所得溶液中Na+的数目为NA |