题目内容
15.工业制氯气的化学反应方程式为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑.与电源正极相连的电极上的产物是Cl2.如何检验湿润的淀粉碘化钾试纸放在排气口变蓝.分析 用惰性电极电解氯化钠溶液生成氢氧化钠、氢气和氯气;阳极上发生氧化反应,氯离子失去电子生成氯气,氯气具有强的氧化性,能够使湿润的淀粉碘化钾试纸放在排气口变蓝,据此解答.
解答 解:电解饱和食盐水生成氢氧化钠和氢气、氯气,电解方程式:2NaCl+2H2O $\frac{\underline{\;电解\;}}{\;}$ 2NaOH+H2↑+Cl2↑;
与电源正极相连的电极是阳极,阳极上发生氧化反应,氯离子失去电子生成氯气,氯气具有强的氧化性,能够使湿润的淀粉碘化钾试纸放在排气口变蓝,
故答案为:2NaCl+2H2O $\frac{\underline{\;电解\;}}{\;}$ 2NaOH+H2↑+Cl2↑; Cl2;湿润的淀粉碘化钾试纸放在排气口变蓝.
点评 本题考查了电解饱和食盐水,明确电解池工作原理,熟悉氯气性质即可解答,题目难度不大.

练习册系列答案
相关题目
5.下列叙述中,正确的是( )
| A. | 由同种元素组成的物质一定属于纯净物 | |
| B. | NaHCO3在水中电离:NaHCO3═Na++H++CO32- | |
| C. | 含金属元素的离子不一定都是阳离子 | |
| D. | 具有相同质子数的微粒都属于同种元素 |
10.中学化学实验,淡黄色的pH试纸常用于测定溶液的酸碱性.在 25℃,若溶液的pH=7,试纸不变色;若pH<7,试纸变红色;若pH>7,试纸变蓝色.而要精确测定溶液的pH,需用pH计.pH计主要通过测定溶液中H+浓度来测定溶液的pH.
(1)已知水中存在如下平衡H2O?H++OH-△H>0.现欲使平衡向右移动,且所得溶液呈中性,选择的方法是C(字母).
A.向水中加入NaHSO4溶液
B.向水中加入Cu(OH)2固体
C.加热水至100℃[其中c(H+)=1×10-6 mol•L-1]
D.在水中加入H2SO4溶液
(2)现欲测定100℃沸水的pH及酸碱性,若用pH试纸测定,则试纸显淡黄色,若用pH计测定,则pH<7 (填“>”“<”或“=”),溶液呈中性(填“酸”“碱”或“中”).
(3)某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5 μm的悬浮颗粒物),其主要来源为燃煤、机动车尾气等.因此,对PM2.5、SO2、NOx等进行研究具有重要意义.若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
根据表中数据判断PM2.5的酸碱性为酸性,试样的pH=4.
(4)①已知汽缸中生成NO的反应为N2(g)+O2(g)?2NO(g)△H>0,汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是吸热反应,温度升高,平衡正向移动,NO的含量增大.
②汽车燃油不完全燃烧时产生CO,有人设计下列反应除去CO:2CO(g)=2C(s)+O2(g),已知该反应的△H>0,简述该设想能否实现的依据△H>0△S<0,则在任何温度下△G>0,不可能自发进行.
(1)已知水中存在如下平衡H2O?H++OH-△H>0.现欲使平衡向右移动,且所得溶液呈中性,选择的方法是C(字母).
A.向水中加入NaHSO4溶液
B.向水中加入Cu(OH)2固体
C.加热水至100℃[其中c(H+)=1×10-6 mol•L-1]
D.在水中加入H2SO4溶液
(2)现欲测定100℃沸水的pH及酸碱性,若用pH试纸测定,则试纸显淡黄色,若用pH计测定,则pH<7 (填“>”“<”或“=”),溶液呈中性(填“酸”“碱”或“中”).
(3)某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5 μm的悬浮颗粒物),其主要来源为燃煤、机动车尾气等.因此,对PM2.5、SO2、NOx等进行研究具有重要意义.若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| $\frac{浓度}{(mol•{L}^{_1})}$ | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
(4)①已知汽缸中生成NO的反应为N2(g)+O2(g)?2NO(g)△H>0,汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是吸热反应,温度升高,平衡正向移动,NO的含量增大.
②汽车燃油不完全燃烧时产生CO,有人设计下列反应除去CO:2CO(g)=2C(s)+O2(g),已知该反应的△H>0,简述该设想能否实现的依据△H>0△S<0,则在任何温度下△G>0,不可能自发进行.
4.下列有关物质检验的实验结论正确的是( )
| 选项 | 实 验 操 作 及 现 象 | 实 验 结 论 |
| A | 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 | 该溶液中一定含有SO${\;}_{4}^{2-}$ |
| B | 向某溶液中加入盐酸,能产生使澄清石灰水变浑浊的气体 | 该溶液中一定含CO32- |
| C | 向某溶液中加入适量NaOH稀溶液,将湿润的红色石蕊试纸放在试管口,试纸不变色 | 该溶液中一定不含NH4+ |
| D | 用干燥洁净的铂丝蘸取某溶液放在酒精灯火焰上灼烧,透过蓝色钴玻璃观察到火焰呈紫色 | 该溶液一定含有钾元素,可能含有钠元素 |
| A. | A | B. | B | C. | C | D. | D |
5.在0.5LNaCl溶液中含有58.5gNaCl,该溶液中溶质的物质的量浓度为( )
| A. | 2.0mol/L | B. | 1.0mol/L | C. | 0.5mol/L | D. | 0.2mol/L |
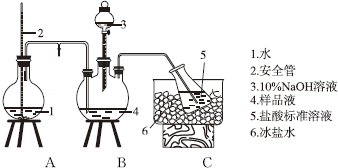
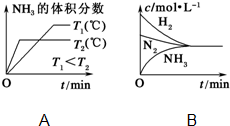 已知工业上合成氨反应N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol,回答以下问题:
已知工业上合成氨反应N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol,回答以下问题: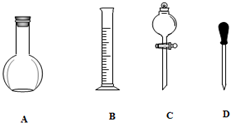 实验室需要0.1mol/LNaOH溶液450mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.
实验室需要0.1mol/LNaOH溶液450mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.