题目内容
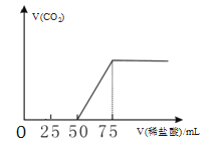
【题目】2019年9月起,澳大利亚山火已经持续100多天,产生了大量温室气体。有50mLNaOH溶液,向其中逐渐通入一定量的CO2,然后向溶液中逐滴加入0.1mol/L的稀盐酸,产生的CO2气体体积(标准状况)与所加入的盐酸的体积之间的关系如图所示。下列说法正确的是
A.滴加盐酸过程中,混合溶液的导电能力不断增强
B.滴加盐酸过程中,混合溶液中c(CO32-)、c(HCO3-)、c(H2CO3)之和不断减小
C.V(稀盐酸)=25mL时,c(H+)+c(H2CO3)=c(CO32-)+c(OH-)
D.V(稀盐酸)=50mL时,c(Na+)=c(H2CO3)+c(HCO3-)+c(CO32-)
【答案】B
【解析】
由图可知,加入50mL盐酸之前,反应无气体生成,且再加入25mL即反应到达终点,即通入一定量二氧化碳后,溶液为等物质的量的氢氧化钠和碳酸钠的混合溶液,实验分为三个阶段:第一阶段,滴入的25mL盐酸和氢氧化钠反应;第二阶段,继续滴入的25mL盐酸与碳酸钠反应生成碳酸氢钠;第三阶段,滴入的25mL盐酸与碳酸氢钠反应生成二氧化碳。
A. 滴加盐酸过程中,第一阶段,盐酸与NaOH反应生成NaCl,离子总数不变,但溶液体积增大,所以离子浓度降低,导电性减弱;第三阶段,盐酸与碳酸氢钠反应产生二氧化碳,混合溶液中离子浓度也下降,导电能力不断减弱,A错误;
B. 滴加盐酸过程中,由于溶液体积变大,所以根据物料守恒可知,溶液中c(CO32-)+c(HCO3-)+c(H2CO3)不断减小,在第三阶段,随着盐酸加入,二氧化碳逸出,使c(CO32-)、c(HCO3-)、c(H2CO3)之和更小,B正确;
C. V(稀盐酸)=25mL时,盐酸恰好消耗完氢氧化钠,为等物质的量的碳酸钠和氯化钠混合溶液,溶液中CO32-是大量的,而H+和H2CO3是少量的,所以c(H+)+c(H2CO3) <c(CO32-) + c(OH-),C错误;
D. V(稀盐酸)=50mL时,溶液为碳酸氢钠和氯化钠混合溶液,根据物料守恒可知,c(Na+)=c(H2CO3)+c(HCO3-)+c(CO32-)+c(Cl-),D错误;
答案为B。

【题目】已知:CO(g) + H2O(g) ![]() H2(g) + CO2(g) 的平衡常数K随温度的变化如下表,下列说法正确的是( )
H2(g) + CO2(g) 的平衡常数K随温度的变化如下表,下列说法正确的是( )
温度/℃ | 400 | 500 | 830 | 1000 |
平衡常数K | 10 | 9 | 1 | 0.6 |
A. 该反应的正反应是吸热反应
B. 恒温时增大压强,正反应速率增大
C. 830℃时,反应达到平衡,一定是c(CO)=c(CO2)
D. 400℃时,生成CO2物质的量越多,平衡常数K越大
【题目】对比类推法是一种常用的学习和研究方法。下列离子方程式的书写正确且类推合理的是
选项 | 离子方程式 | 类推 |
A | 家庭漂白原理:Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO | 向漂白粉溶液中通入少量的SO2气体:Ca2++2ClO-+H2O+SO2=CaSO3↓+2HClO |
B | 向FeBr2溶液中通入少量的Cl2:2Fe2++Cl2=2Fe3++2Cl- | 向FeI2溶液中通入少量的Cl2:2Fe2++Cl2=2Fe3++2Cl- |
C | 用石墨电极电解NaCl饱和溶液:2H2O+2Cl- | 用石墨电极电解AlCl3饱和溶液:2H2O+2Cl- |
D | 明矾净水:Al3++3H2O | 硫酸铁净水:Fe3++3H2O |
A.AB.BC.CD.D