题目内容
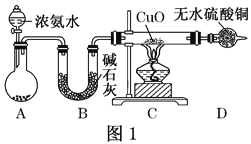
【题目】为了探究某带结晶水的固体X(含四种短周期元素)的组成和性质,设计并完成如下实验

请回答:(1)白色固体D是________。
(2)无色溶液![]() 白色沉淀F的离子方程式是________。
白色沉淀F的离子方程式是________。
(3)X的化学式是________。
【答案】![]() (或氧化镁)
(或氧化镁) ![]() MgC2O4
MgC2O4![]() 4H2O
4H2O
【解析】
混合气体A经过浓硫酸得混合气体B,B在标况下体积为896mL,物质的量为0.04mol,混合气体B通入澄清的石灰水,产生白色沉淀为CaCO3,白色沉淀的质量为2.00g,则物质的量为0.02mol,所以n(CO2)=0.02mol,根据框图可知含n(CO)=0.02mol,所以含C的物质的量为0.04mol。由框图加入足量的氢氧化钠,产生白色沉淀F为1.16g,可知白色沉淀F为Mg(OH)2,物质的量为n[Mg(OH)2]=![]() =0.02mol,n(Mg2+)=0.02mol,白色固体D的摩尔质量为M=
=0.02mol,n(Mg2+)=0.02mol,白色固体D的摩尔质量为M=![]() =40g/mol,所以D为MgO,所以n(MgO)=0.02mol,含O为0.02mol,根据质量守恒,m=0.02mol
=40g/mol,所以D为MgO,所以n(MgO)=0.02mol,含O为0.02mol,根据质量守恒,m=0.02mol![]() 40g/mol+0.02mol
40g/mol+0.02mol![]() 44g/mol+0.02mol
44g/mol+0.02mol![]() 28g/mol=2.24g,所以水的质量为:2.96g-2.24g=0.72g,水的物质的量为n(H2O)=0.04mol,含n(H)=0.08mol。
28g/mol=2.24g,所以水的质量为:2.96g-2.24g=0.72g,水的物质的量为n(H2O)=0.04mol,含n(H)=0.08mol。
(1)由框图加入足量的氢氧化钠,产生白色沉淀F为1.16g,可知白色沉淀F为 Mg(OH)2,物质的量为n[Mg(OH)2]=![]() =0.02mol,n(Mg2+)=0.02mol,白色固体D的摩尔质量为M=
=0.02mol,n(Mg2+)=0.02mol,白色固体D的摩尔质量为M=![]() =40g/mol,所以D为MgO;答案:MgO。
=40g/mol,所以D为MgO;答案:MgO。
(2)由框图可知MgO与盐酸反应生成无色溶液E为MgCl2,无色溶液与足量的氢氧化钠,产生白色沉淀F为Mg(OH)2,反应的的离子方程式是:Mg2++ 2OH-= Mg(OH)2![]() ,答案:Mg2++ 2OH-= Mg(OH)2
,答案:Mg2++ 2OH-= Mg(OH)2![]()
(3)由上述分析可知X中含Mg、C、O、H的物质量的比为:0.02mol:0.04mol:0.10mol:0.08mol=1:2:5:4,所以X的化学式是MgC2O4![]() 4H2O;答案:MgC2O4
4H2O;答案:MgC2O4![]() 4H2O。
4H2O。