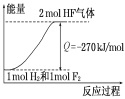
题目内容
【题目】人类的农业生产离不开氮肥,几乎所有的氮肥都以氨为原料,某化学兴趣小组利用图一装置制备氨气并探究相关性质。
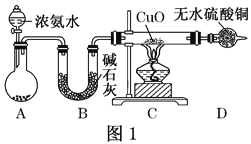
(1)装置A中,盛有浓氨水的仪器名称为_____,烧瓶内药品可选用______。装置B的作用是______。
(2)连接好装置并检验装置的气密性后,装入药品,然后应先_____(填I或Ⅱ)。
Ⅰ.打开旋塞逐滴向圆底烧瓶中加入氨水 Ⅱ.加热装置C
(3)实验中观察到C中CuO粉末变红,D中无水硫酸铜变蓝,并收集到一种单质气体,则该反应相关化学方程式为______,该反应证明氨气具有______性;氨跟氧气的反应也体现了这一性质,反应方程式为______。
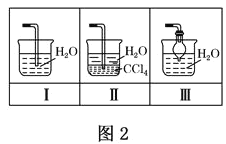
(4)该实验缺少尾气吸收装置,图二中能用来吸收尾气的装置是_____(填装置序号)。
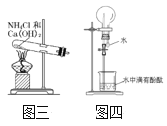
(5)实验室还可用图三所示装置制备氨气,化学反应方程式为_____;用圆底烧瓶收集干燥的氨气,用图四装置进行喷泉实验,挤压胶头滴管时,可以得到红色喷泉,原因(用方程式表示)是______。
(6)尿素CO(NH2)2是一种常用化肥,缓慢与水发生非氧化还原反应释放出氨气,则尿素中C的化合价为价_____。
【答案】分液漏斗 碱石灰或生石灰 干燥氨气 I 3CuO+2NH3![]() 3Cu+N2+3H2O 还原 4NH3+5O2
3Cu+N2+3H2O 还原 4NH3+5O2![]() 4NO+6H2O Ⅱ、Ⅲ 2NH4Cl+Ca(OH)2
4NO+6H2O Ⅱ、Ⅲ 2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O ![]() +4
+4
【解析】
浓氨水在碱石灰或生石灰的作用下挥发生成氨气,在B中用碱石灰干燥,在C中加热与氧化铜发生氧化还原反应生成水、氮气和铜,D可用于检验是否生成水,最后氨气用水吸收,因氨气极易溶于水,注意防止倒吸;NH4Cl与Ca(OH)2在加热条件下反应生成氯化钙、氨气、水,氨气为碱性气体,极易溶于水,可据此做喷泉实验。
(1)根据仪器装置图可知,盛有浓氨水的仪器名称为分液漏斗;浓氨水在碱石灰或生石灰的作用下挥发生成氨气,生成的氨气中含有水分,若直接通入C中,会导致C中石英管破裂,因此选用碱石灰进行干燥,故答案为:分液漏斗;碱石灰或生石灰;干燥氨气;
(2)整个装置中含有空气,连接好装置并检验装置的气密性后,装入药品,打开旋塞逐滴向圆底烧瓶中加入氨水发生反应生成氨气,通过氧化铜的颜色变化分析氨气的性质,故答案为:I;
(3)实验中观察到C中CuO粉末变红证明生成铜,D中无水硫酸铜变蓝生成水,并收集到一种单质气体,依据氧化还原反应分析,氧化铜氧化氨气为氮气,氧化铜被还原为铜,反应的化学方程式为:3CuO+2NH3![]() 3Cu+N2+3H2O;氮元素化合价升高为0价,作还原剂具有还原性;氨气与氧气反应生成NO、H2O,其反应方程式为:4NH3+5O2
3Cu+N2+3H2O;氮元素化合价升高为0价,作还原剂具有还原性;氨气与氧气反应生成NO、H2O,其反应方程式为:4NH3+5O2![]() 4NO+6H2O,故答案为:3CuO+2NH3
4NO+6H2O,故答案为:3CuO+2NH3![]() 3Cu+N2+3H2O;还原;4NH3+5O2
3Cu+N2+3H2O;还原;4NH3+5O2![]() 4NO+6H2O;
4NO+6H2O;
(4)氨气极易溶于水尾气吸收需要防止倒吸,图二中能用来吸收尾气的装置是Ⅱ、Ⅲ,装置Ⅰ易发生倒吸,故答案为:Ⅱ、Ⅲ;
(5)NH4Cl与Ca(OH)2在加热条件下反应生成氯化钙、氨气、水,其反应方程式为:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O;氨气为碱性气体,其溶于水生成一水合氨,一水合氨发生电离使溶液呈碱性,使含有酚酞的溶液呈红色,一水合氨的电离方程式为:
CaCl2+2NH3↑+2H2O;氨气为碱性气体,其溶于水生成一水合氨,一水合氨发生电离使溶液呈碱性,使含有酚酞的溶液呈红色,一水合氨的电离方程式为:![]() ,故答案为:2NH4Cl+Ca(OH)2
,故答案为:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O;![]() ;
;
(6)其反应为非氧化还原反应,说明N元素化合价为-3价,H元素化合价为+1价,O元素化合价为-2价,根据化合物中化合价代数和为0可知C元素化合价为+4价。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】青蒿素是一种有效的抗疟药。常温下,青蒿素为无色针状晶体,难溶于水,易溶于有机溶剂,熔点为156~157℃。提取青蒿素的方法之一是乙醚浸取法,提取流程如下:

请回答下列问题:
(l)对青蒿进行破碎的目的是__________________。
(2)操作I用到的玻璃仪器是__________,操作Ⅱ的名称是_______。
(3)用下列实验装置测定青蒿素的化学式,将28.2g青蒿素放在燃烧管C中充分燃烧:

① 仪器各接口的连接顺序从左到右依次为_______(每个装置限用一次)。A装置中发生的化学反应方程式为_________________。
② 装置C中CuO的作用是_________________。
③ 装置D中的试剂为_________________。
④ 已知青蒿素是烃的含氧衍生物,用合理连接后的装置进行实验.测量数据如下表:
装置质量 | 实验前/g | 实验后/g |
B | 22.6 | 42.4 |
E(不含干燥管) | 80.2 | 146.2 |
则青蒿素的最简式为__________。
(4)某学生对青蒿素的性质进行探究。将青蒿素加入含有NaOH 、酚酞的水溶液中,青蒿素的溶解度较小,加热并搅拌,青蒿素的溶解度增大,且溶液红色变浅,与青蒿素化学性质相似的物质是______(填字母代号)。
A.乙醇 B.乙酸 C.乙酸乙酯 D.葡萄糖