题目内容
【题目】下列说法正确的是
A.1 mol O2的体积是22.4 L
B.1.7 g NH3中含有的质子数约为6.02×1023
C.8 g S在足量O2中完全燃烧转移的电子数约为3.01×1023
D.0.5 mol·L1NaCl溶液中含有Cl的物质的量为0.5 mol
【答案】B
【解析】
A、气体摩尔体积受温度和压强影响,温度和压强未知导致气体摩尔体积未知,则无法计算气体体积,故A错误;
B、1.7gNH3的物质的量为n=![]() =
=![]() =0.1mol,1个NH3中含有10个质子,0.1molNH3的质子数为1mol,所以,1molNH3的质子数数目约为6.02×1023,故B正确;
=0.1mol,1个NH3中含有10个质子,0.1molNH3的质子数为1mol,所以,1molNH3的质子数数目约为6.02×1023,故B正确;
C、8gS物质的量为:![]() =0.25mol,在足量O2中完全燃烧转移的电子数约0.25×4×6.02×1023=6.02×1023,故C错误;
=0.25mol,在足量O2中完全燃烧转移的电子数约0.25×4×6.02×1023=6.02×1023,故C错误;
D、溶液体积未知,无法计算氯离子个数,故D错误。
答案选B。

 备战中考寒假系列答案
备战中考寒假系列答案【题目】青蒿素是一种有效的抗疟药。常温下,青蒿素为无色针状晶体,难溶于水,易溶于有机溶剂,熔点为156~157℃。提取青蒿素的方法之一是乙醚浸取法,提取流程如下:

请回答下列问题:
(l)对青蒿进行破碎的目的是__________________。
(2)操作I用到的玻璃仪器是__________,操作Ⅱ的名称是_______。
(3)用下列实验装置测定青蒿素的化学式,将28.2g青蒿素放在燃烧管C中充分燃烧:

① 仪器各接口的连接顺序从左到右依次为_______(每个装置限用一次)。A装置中发生的化学反应方程式为_________________。
② 装置C中CuO的作用是_________________。
③ 装置D中的试剂为_________________。
④ 已知青蒿素是烃的含氧衍生物,用合理连接后的装置进行实验.测量数据如下表:
装置质量 | 实验前/g | 实验后/g |
B | 22.6 | 42.4 |
E(不含干燥管) | 80.2 | 146.2 |
则青蒿素的最简式为__________。
(4)某学生对青蒿素的性质进行探究。将青蒿素加入含有NaOH 、酚酞的水溶液中,青蒿素的溶解度较小,加热并搅拌,青蒿素的溶解度增大,且溶液红色变浅,与青蒿素化学性质相似的物质是______(填字母代号)。
A.乙醇 B.乙酸 C.乙酸乙酯 D.葡萄糖
【题目】毒重石的主要成分为BaCO3(含Ca2+、Mg2+、Fe3+等杂质)。实验室利用毒重石制备BaCl2·2H2O的流程如图:
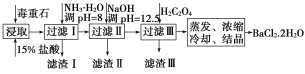
(1)毒重石用盐酸浸取前需充分研磨,目的是__。
(2)加入NH3·H2O调pH=8可除去__(填离子符号),滤渣Ⅱ中含__(填化学式)。加入H2C2O4时应避免过量,原因是__。
已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的pH | 13.9 | 11.1 | 3.2 |
(3)利用间接酸碱滴定法可测定Ba2+的含量,实验分两步进行。
已知:2CrO42-+2H+=Cr2O72-+H2O
Ba2++CrO42-=BaCrO4↓
步骤Ⅰ:移取xmL一定浓度的Na2CrO4溶液于锥形瓶中,加入酸碱指示剂,用bmol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V0mL。
步骤Ⅱ:移取ymLBaCl2溶液于锥形瓶中,加入xmL与步骤Ⅰ相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用bmol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1mL。
滴加盐酸标准液时应使用酸式滴定管,“0”刻度位于滴定管的__(填“上方”或“下方”)。BaCl2溶液的浓度为__mol·L-1。若步骤Ⅱ中滴加盐酸时有少量待测液溅出,Ba2+浓度测量值将__(填“偏大”或“偏小”)。