题目内容
【题目】用软锰矿(主要成分为MnO2)生产高锰酸钾产生的锰泥中,还含有18%的MnO2、3%的KOH(均为质量分数),及少量Cu、Pb的化合物等,用锰泥可回收制取MnCO3,过程如图:

(1)高锰酸钾的氧化性强弱与溶液的酸碱性有关,在酸性条件下其氧化性较强。通常用来酸化高锰酸钾的酸是______
A.H2SO4 B.HCl C.HNO3
(2)除去滤液1中Cu2+的离子方程式是___________________________
(3)经实验证明:MnO2稍过量时,起始H2SO4、FeSO4混合溶液中![]() <0.7时,滤液1中能够检验出有Fe2+;
<0.7时,滤液1中能够检验出有Fe2+;![]() ≥0.7时,滤液1中不能检验出有Fe2+。根据上述信息回答①②:
≥0.7时,滤液1中不能检验出有Fe2+。根据上述信息回答①②:
①检验Fe2+是否氧化完全的实验试剂是__________ A.KSCN B.K3Fe(CN)6
②若![]() >1,调节
>1,调节![]() 到0.7~1的最理想试剂是_______(填序号)
到0.7~1的最理想试剂是_______(填序号)
a.NaOH溶液 b.铁粉 c.MnO。
(4)写出滤液2中加入过量NH4HCO3反应的离子方程式__________。
(5)上述过程锰回收率可达95%,若处理1740 kg的锰泥,可生产MnCO3__________kg。
【答案】A Cu2++ S2-= CuS↓ B b Mn2++2HCO3-=MnCO3↓+CO2↑+H2O 393.3
【解析】
H2SO4、FeSO4混合溶液与锰泥中的二氧化锰发生氧化还原反应,将亚铁氧化为三价铁,然后过滤滤去未反应掉的二氧化锰和不溶的杂质,向滤液中加氨水来调节溶液的PH值,并用硫化钠来沉淀铜离子和铅离子,然后过滤滤去生成的沉淀,最后向滤液中加入过量的碳酸氢铵生成碳酸锰;
(1)高锰酸钾溶液具有强氧化性,盐酸易被氧化生成氯气;硝酸本身具有氧化性,对高锰酸钾氧化性的体现会造成影响,一般用稀硫酸酸化,
故答案为:A;
(2)除去滤液1中Cu2+的是硫离子和铜离子反应生成难溶于水的CuS,反应的离子方程式为:Cu2++S2-=CuS↓,
故答案为:Cu2++S2-=CuS↓;
(3)①检验Fe3+的存在用硫氰化钾溶液,观察是否出现血红色,检验Fe2+的存在加入铁氰化钾溶液,观察溶液是否变蓝,
故答案选B。
②若![]() >1,调节
>1,调节![]() 到0.7~1的的方法是减小氢离子而增加亚铁离子的浓度,所以最好加入铁与氢离子发生氧化反应,生成氢气从而消耗氢离子,同时生成亚铁离子,所以应向混合溶液中加适量铁粉,
到0.7~1的的方法是减小氢离子而增加亚铁离子的浓度,所以最好加入铁与氢离子发生氧化反应,生成氢气从而消耗氢离子,同时生成亚铁离子,所以应向混合溶液中加适量铁粉,
故答案为:b;
(4)滤液2中的锰离子与NH4HCO3反应生成碳酸锰和二氧化碳与水,所以离子方程式为:Mn2++2HCO3-=MnCO3↓+CO2↑+H2O,
故答案为:Mn2++2HCO3-=MnCO3↓+CO2↑+H2O;
(5)锰泥中含18%的MnO2,锰回收率可达95%,根据关系式
MnO2~~~~~~~~MnCO3,
87 115
1740kg×18%×95% m
解之得m=393.3kg,
故答案为:393.3。

 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
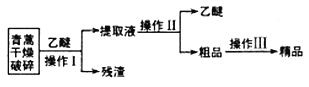
金状元绩优好卷系列答案【题目】青蒿素是一种有效的抗疟药。常温下,青蒿素为无色针状晶体,难溶于水,易溶于有机溶剂,熔点为156~157℃。提取青蒿素的方法之一是乙醚浸取法,提取流程如下:
请回答下列问题:
(l)对青蒿进行破碎的目的是__________________。
(2)操作I用到的玻璃仪器是__________,操作Ⅱ的名称是_______。
(3)用下列实验装置测定青蒿素的化学式,将28.2g青蒿素放在燃烧管C中充分燃烧:
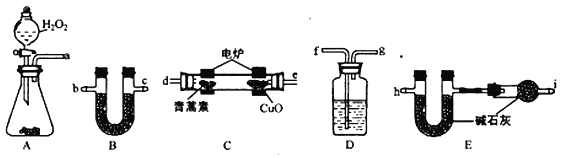
① 仪器各接口的连接顺序从左到右依次为_______(每个装置限用一次)。A装置中发生的化学反应方程式为_________________。
② 装置C中CuO的作用是_________________。
③ 装置D中的试剂为_________________。
④ 已知青蒿素是烃的含氧衍生物,用合理连接后的装置进行实验.测量数据如下表:
装置质量 | 实验前/g | 实验后/g |
B | 22.6 | 42.4 |
E(不含干燥管) | 80.2 | 146.2 |
则青蒿素的最简式为__________。
(4)某学生对青蒿素的性质进行探究。将青蒿素加入含有NaOH 、酚酞的水溶液中,青蒿素的溶解度较小,加热并搅拌,青蒿素的溶解度增大,且溶液红色变浅,与青蒿素化学性质相似的物质是______(填字母代号)。
A.乙醇 B.乙酸 C.乙酸乙酯 D.葡萄糖
【题目】探究铁在某浓度H3PO4和H2O2的混合溶液中反应的情况,进行如下实验:
实验 | 操作 | 现象 |
Ⅰ | 将除去氧化膜的铁钉置于烧杯中,加入30 mL 1.0 mol·L1 H3PO4和 3 mL 30% H2O2的混合溶液(pH≈1)。 | 一段时间后铁钉表面突然产生大量气泡,随后停止产生气泡;一段时间后再产生大量气泡,再停止,出现周而往复的现象。过程中,溶液保持澄清。
|
Ⅱ | 将与实验Ⅰ相同的铁钉放入烧杯中,加入30 mL 1.0 mol·L1H3PO4和3 mL H2O。 | 片刻后铁钉表面持续产生气泡,溶液保持澄清。 |
已知:Fe3(PO4)2难溶于水,Fe(H2PO4)2溶于水。
(1)用85% H3PO4配制100 mL 1.0 mol·L1H3PO4所用的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管、______。
(2)实验Ⅱ中铁钉表面产生气体的化学方程式是______。
(3)探究停止产生气泡的原因。
提出假设:铁钉表面形成了含有+3价铁的氧化膜将铁钉覆盖。
甲同学进行实验Ⅲ,得出假设成立的结论。
实验Ⅲ:将洗净的实验Ⅰ中无气泡产生时的铁钉置于试管中,加入滴有KSCN溶液的稀H2SO4,振荡,静置,溶液呈红色。
乙同学认为实验Ⅲ无法证实假设成立,其理由是_____。
乙同学通过改进实验证实了假设成立。
(4)铁钉表面突然产生大量气泡的可能原因是Fe2+迅速被H2O2氧化形成氧化膜,使聚集在铁钉表面的H2脱离铁钉表面。
①实验Ⅳ证实了形成氧化膜过程中产生H+。
实验Ⅳ:______(填操作),滴入少量FeSO4溶液后,立即测定pH,pH迅速降低。
②形成氧化膜(以Fe2O3计)的离子方程式是______。
(5)实验Ⅰ中周而往复的现象与铁钉表面氧化膜的生成和溶解密切相关,从反应的速率
角度分析其原因:______。