题目内容
18.某二元酸(化学式用H2A表示)在水中的电离方程式是:H2A═H++HA;HA-?H++A2-回答下列问题:(1)Na2A溶液显碱性(填“酸性、中性或碱性”)理由是:H2O+A2-?HA-+OH-(用离子方程式表示)
(2)在0.1mol•L-1的Na2A溶液中,下列微粒浓度关系式正确的是:BCD.
A.c(A2-)+c( HA-)+c( H2A)=0.1mol•L-1
B.c(OH-)=c(H+)+c( HA-)
C.c(Na+ )+c(H+)=c(OH-)+c( HA-)+2c(A2-)
D.c(Na+ )=2c(A2-)+2c( HA-)
(3)已知0.1mol•L-1NaHA溶液的pH=2,则0.1mol•L-1 H2A溶液中氢离子的物质的量浓度可能是<0.11mol•L-1(填“<”,“>”,或“=”),理由是:H2A第一步电离产生的H+,抑制了HA-的电离
(4)0.1mol•L-1NaHA溶液中各种离子浓度由大到小的顺序是:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-).
分析 H2A在水中的电离方程式:H2A═H++HA-;HA-?H++A2-,其第一步完全电离,第二部电离可逆,HA-只电离不水解,
(1)强碱弱酸盐中阴离子水解导致溶液显示碱性,根据水解方程式的书写方法来回答;
(2)根据溶液中的电荷守恒、物料守恒以及质子守恒来回答;
(3)0.1mol•L-1H2A溶液,H2A?H++HA-,电离出H+小于0.1mol/L,0.1mol•L-1NaHA溶液的pH=2,则由HA-?H++A2-可知,电离出0.01mol/LH+,但第一步电离生成的H+抑制了HA-的电离;
(4)NaHA溶液显酸性,存在HA-?H++A2-,则c(Na+)>c(HA-)>c(H+)>c(OH-),结合水的电离分析.
解答 解:(1)根据H2A的电离是分步电离可以知道H2A是弱酸,所以Na2A溶液显碱性,水解原理是:H2O+A2-?HA-+OH-,
故答案为:碱性;H2O+A2-?HA-+OH-;
(2)0.1mol•L-1的Na2A溶液中,A2-能够水解生成HA-,HA-不水解,
A、根据物料守恒,c(A2-)+c(HA-)=0.1mol/L,故A错误;
B、根据质子守恒:c(OH-)=c(H+)+c( HA-),故B正确;
C、0.1mol/L的Na2A溶液中,存在电荷守恒:c( Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-),故C正确;
D、根据B、C可以得出c(Na+)=2c(A2-)+2c(HA-),故D正确.
故答案为:BCD;
(3)因为0.1mol•L-1NaHA溶液的pH=2,则由HA-?H++A2-可知,电离出0.01mol/LH+;而0.1mol•L-1H2A溶液,H2A=H++HA-,电离出H+0.1mol/L和HA-0.1mol/L,但第一步电离生成的H+抑制了HA-的电离,所以溶液中氢离子的物质的量浓度小于0.1mol/L+0.01mol/L,
故答案为:<;H2A第一步电离产生的H+,抑制了HA-的电离;
(4)NaHA溶液显酸性,存在HA-?H++A2-,则c(Na+)>c(HA-)>c(H+)>c(OH-),结合水的电离H2O?H++OH-,同时有部分A2-发生水解,使c(A2-)减小,所以c(H+)>c(A2-),即NaHA溶液中各种离子浓度由大到小的顺序为c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-),
故答案为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-).
点评 本题考查学生盐的水解规律以及离子浓度之间的守恒关系等方面的知识,注意所学知识的灵活应用,难度不大.

| A. | 过滤 | B. | 蒸馏 | C. | 分液 | D. | 萃取 |
| A. | K+、Mg2+、Cl-、SO42- | B. | Na+、NH4+、SO42-、HCO3- | ||
| C. | Na+、Ba2+、NO3-、Cl- | D. | K+、Na+、NO3-、AlO2- |
| A. | 书写热化学方程式时,只要在化学方程式的右端写上热量的符号和数值即可 | |
| B. | 凡是在加热或点燃条件下进行的反应都是吸热反应 | |
| C. | 把化学反应中物质的变化和反应的焓变同时表示出的化学方程式叫做热化学方程式 | |
| D. | 氢气在氧气中燃烧的热化学方程式是2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ |
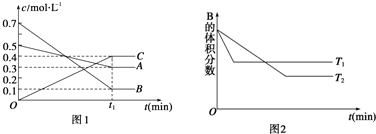
则下列结论正确的是( )
| A. | T℃时,将4 mol A,4 mol B和2 mol C气体通入体积为10 L的密闭容器中(容积不变),达到平衡时,C的浓度为0.4 mol•L-1 | |
| B. | 保持其他条件不变,在(t1+10)min时,加入催化剂,平衡向正反应方向移动 | |
| C. | 保持其他条件不变,在(t1+10)min时,通入稀有气体,平衡向逆反应方向移动 | |
| D. | 保持其他条件不变,升高温度,正、逆反应速率均增大,A的转化率也增大 |
| [H2]/mol•L-1 | [Cl2]/mol•L-1 | v/mol•L-1•s-1 |
| 1.0 | 1.0 | 1.0k |
| 2.0 | 1.0 | 2.0k |
| 2.0 | 4.0 | 4.0k |
| A. | m=1、n=1 | B. | m=$\frac{1}{2}$、n=$\frac{1}{2}$ | C. | m=$\frac{1}{2}$、n=1 | D. | m=1、n=$\frac{1}{2}$ |
| A. | 锌作阳极,镀件作阴极,溶液中有锌离子 | |
| B. | 铂作阴极,镀件作阳极,溶液中有锌离子 | |
| C. | 铁作阳极,镀件作阴极,溶液中有锌离子 | |
| D. | 锌作阴极,镀件作阳极,溶液中有锌离子 |
| A. | 石英与烧碱溶液反应:SiO2+2OH-═SiO32-+H2O | |
| B. | 向氢氧化钠溶液中通入过量CO2:CO2+2OH-═CO32-+H2O | |
| C. | 向硅酸钠溶液中加入盐酸:2H++SiO32-═H2SiO3↓ | |
| D. | 向碳酸钙上滴稀硝酸:CO32-+2H+═H2O+CO2↑ |
