题目内容
4.把2.74g碳酸钠和碳酸氢钠的混合物,加热到质量不再变化时,剩余物质的质量为2.12g,计算混合物中,碳酸钠和碳酸氢钠的质量分数.(Na2CO3:38.7%;NaHCO3:61.3%)分析 碳酸钠较稳定,加热不分解,只有碳酸氢钠分解,加热发生反应:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,利用固体质量差量法计算碳酸氢钠的质量,进而计算碳酸钠、碳酸氢钠的质量分数.
解答 解:碳酸钠较稳定,加热不分解,只有碳酸氢钠分解,设混合物中含有xgNaHCO3,则:
2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O△m
2×84g 62g
xg 2.74g-2.12g=0.62g
所以2×84g:62g=xg:0.62g
解得:x=1.68
所以w(NaHCO3)=$\frac{1.68g}{2.74g}$×100%=61.3%
w(Na2CO3)=1-61.3%=38.7%
答:混合物中碳酸钠的质量分数为38.7%、碳酸氢钠的质量分数为61.3%.
点评 本题考查混合物有关计算,难度不大,注意利用差量法计算解答,侧重考查学生分析计算能力.

练习册系列答案
 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案
相关题目
12.下列有关说法正确的是( )
| A. | 萃取操作可在普通漏斗中完成 | |
| B. | 浓烧碱液沾到皮肤上应立即用稀盐酸冲洗 | |
| C. | 用酒精灯加热试管内液体时一定要先给试管预热再集中加热液体部位 | |
| D. | 用托盘天平称出25.20g氯化钠 |
9.向饱和氯水中加入过量的亚硫酸钠粉末,下列有关说法正确的是( )
| A. | 完全反应后所得溶液具有漂白性 | B. | 只发生了氧化还原反应 | ||
| C. | 会产生有刺激性气味的气体SO2 | D. | 溶液中存在HSO3- |
16.将4.6g钠和4.8g镁分别投入盛有等物质的量浓度、等体积的稀硫酸的两个烧杯中,反应后溶液质量分别为m g和n g,则不可能的关系为( )
| A. | m=n | B. | m>n | C. | m<n | D. | m≤n |
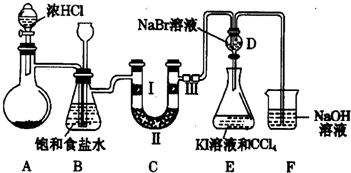
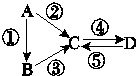 A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如图的反应关系:
A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如图的反应关系: 已知:3Fe(s)+4H2O(g)?Fe3O4(S)+4H2(g),某温度下其平衡常数k=1.在该温度时,在体积为5L的密闭容器中加入3mol Fe(s)与2mol H2O(g),t1秒时测得H2的物质的量为0.70mol.(计算时不用化简)
已知:3Fe(s)+4H2O(g)?Fe3O4(S)+4H2(g),某温度下其平衡常数k=1.在该温度时,在体积为5L的密闭容器中加入3mol Fe(s)与2mol H2O(g),t1秒时测得H2的物质的量为0.70mol.(计算时不用化简)