题目内容
【题目】焦亚硫酸钠(Na2S2O5)在食品加工、印染、印刷、制革以及有机合成等工业中应用广泛。实验室模拟工业湿法制备焦亚硫酸钠装置如图所示。
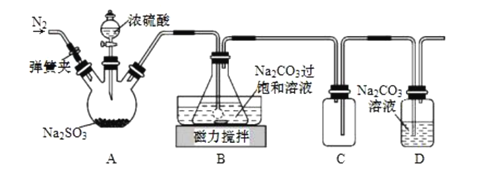
打开弹簧夹,通入一段时间N2后关闭弹簧夹,加入一定量浓硫酸;不断搅拌,控制反应温度在40℃左右,当溶液pH约为4.1时,停止反应,降温至20℃左右静置结晶。
已知:
①温度在40℃左右时,发生反应2NaHSO3=Na2S2O5+H2O。
②温度过高时焦亚硫酸钠分解:Na2S2O5=Na2SO3+SO2↑。
③焦亚硫酸钠与水易发生反应:Na2S2O5+H2O=2NaHSO3。
回答下列问题:
(1)A装置中所加硫酸通常为1:1(体积比)的浓硫酸,一般不采用90%以上的浓硫酸,原因是__。
(2)B装置中控制反应温度40℃在左右的方法是__;锥形瓶中生成NaHSO3的离子方程式为__。
(3)装置C的作用是__。
(4)锥形瓶中析出固体经减压抽滤、洗涤、晾干,可获产品。洗涤操作中依次用饱和SO2水溶液、无水乙醇洗涤,其作用是__。
(5)反应结束后,需要再次打开弹簧夹,通入一段时间N2,目的是__。
(6)某同学认为Na2S2O5属于强碱弱酸盐,在溶液中水解显碱性。实际他测得Na2S2O5溶液显酸性,请用数据帮他分析溶液显酸性的原因__。
(已知:常温下H2SO3电离常数Ka1=1.54×10-2,Ka2=1.02×10-7)
【答案】90%以上的浓硫酸中氢离子浓度小,反应慢 40℃左右的水浴加热 2SO2+CO32-+H2O=2HSO3-+CO2 吸收充分,防止倒吸 饱和SO2水溶液能减少Na2S2O5在水中的溶解,提高产品收率,无水乙醇可以除去晶体表面水分,且易挥发。 使装置内滞留的SO2全部通入D装置中,被Na2CO3溶液吸收 Kh=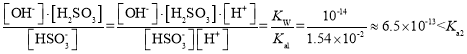 ,HSO3-水解程度小于其电离程度,因此溶液呈酸性
,HSO3-水解程度小于其电离程度,因此溶液呈酸性
【解析】
打开弹簧夹,通入一段时间N2将装置内的其他气体排尽,关闭弹簧夹,A装置中用浓硫酸和亚硫酸钠反应制取二氧化硫,在不断搅拌下,控制反应温度在40℃左右,向Na2CO3过饱和溶液中通入SO2,发生反应生成NaHSO3和CO2,多余的二氧化硫可用氢氧化钠溶液吸收,因二氧化硫易溶于氢氧化钠溶液,C为安全瓶,可防止倒吸。
(1)A装置中利用硫酸和Na2SO3发生复分解反应生成SO2;90%以上的浓硫酸水少,难电离,c(H+)小;
(2)B装置中控制反应温度在40℃左右的方法是水浴加热;向Na2CO3过饱和溶液中通入SO2,发生反应生成NaHSO3和CO2,反应的离子方程式为2SO2+CO32+H2O=2HSO3+CO2;
(3)二氧化硫易溶于碱性溶液,C为安全瓶,可防止倒吸;
(4)由反应2NaHSO3===Na2S2O5+H2O可知,增大HSO3-的浓度,有利于生成Na2S2O5,用饱和SO2水溶液洗涤,可降低Na2S2O5的溶解度,减少Na2S2O5的溶解,无水乙醇洗涤,可以除去晶体表面水分,且乙醇易挥发;
(5)反应结束后,通入氮气是将滞留的SO2全部赶到装置D中被吸收;
(6)焦亚硫酸钠与水易发生反应:Na2S2O5+H2O===2NaHSO3,溶液中HSO3-既能电离,又能水解,因为水解常数Kh=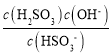 =
=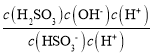 =
=![]() =6.5×10-13<Ka2,所以HSO3-的电离程度大于其水解程度,溶液显酸性。
=6.5×10-13<Ka2,所以HSO3-的电离程度大于其水解程度,溶液显酸性。