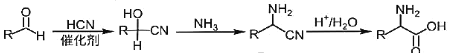
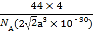题目内容
【题目】以物质的量为中心的相关计算,已知阿伏加德罗常数为NA。
(1)质量相同的H2、NH3、SO2、O3四种气体中,含有分子数目最少的是_________,在相同温度和相同压强条件下,体积最大的是___________。
(2)73.0g HCl气体中含有_______个分子、______个质子。
(3)23.75 g某+2价金属的氯化物(MCl2)中含有3.01×1023个Cl-,则MCl2的摩尔质量为______, M的相对原子质量为________。
(4)将0.5L1mol/L FeCl3溶液加水稀释至1L,所得溶液中氯离子的物质的量浓度是_____。
(5)3.01×1023个CO2在标准状况下的体积约为______L,它与_____g CO含有相同的氧原子数。
(6)在标准状况下22.4 L由氮气和氧气组成的混合气体,其质量为30g,则其中氧气的质量为________g。
【答案】SO2 H2 2NA 36NA 95g/mol 24 1.5mol/L 11.2 28 16
【解析】
(1)质量相同的H2、NH3、SO2、O3四种气体中,N=nNA=mNA/M可知,质量相同时气体分子数与摩尔质量成反比,摩尔质量越大,含有的分子数越小,所以含有分子数最少的是摩尔质量最大的为SO2;由V=![]() ×Vm可知,质量相同时,气体体积与摩尔质量成反比,体积最大的是气体摩尔质量最小的,则体积增大的为H2;
×Vm可知,质量相同时,气体体积与摩尔质量成反比,体积最大的是气体摩尔质量最小的,则体积增大的为H2;
(2)73.0gHCl气体的物质的量为:n(HCl)=73.0g÷36.5g/mol=2mol,2molHCl中含有2NA个HCl分子,含有质子数为:2NA×18=36NA;
(3)因MCl2中含有3.01×1023个Cl,则Cl的物质的量为![]() =0.5mol,M2+的物质的量0.25mol,即MCl2的物质的量为0.25mol,MCl2的摩尔质量M=
=0.5mol,M2+的物质的量0.25mol,即MCl2的物质的量为0.25mol,MCl2的摩尔质量M=![]() =
=![]() =95g/mol;因MCl2的摩尔质量为95g/mol,所以相对分子质量为95,金属M的相对原子质量为95-35.5×2=24;
=95g/mol;因MCl2的摩尔质量为95g/mol,所以相对分子质量为95,金属M的相对原子质量为95-35.5×2=24;
(4)0.5L1mol/LFeCl3溶液中氯离子的浓度为3mol/L,根据稀释定律,稀释前后氯离子的物质的量不变,令稀释后所得溶液中氯离子的浓度为c,则0.5L×3mol/L=1L×c,解得c=1.5mol/L;
(5)3.01×1023个CO2物质的量为![]() =0.5mol,标况下体积V=0.5mol×22.4L/mol=11.2L;含有氧原子个数为:0.5×2×NA=NA个,则:
=0.5mol,标况下体积V=0.5mol×22.4L/mol=11.2L;含有氧原子个数为:0.5×2×NA=NA个,则:![]() ×1×NA=NA,解得m(CO)=28g;
×1×NA=NA,解得m(CO)=28g;
(6)标况下22.4L混合气体的物质的量n=![]() =1mol,设氮气的物质的量为xmol,氧气的物质的量为ymol,根据物质的量为1mol,质量为30g可知:x+y=1①,28x+32y=30②,解①②可得y=0.5,则氧气的质量m=nM=0.5mol×32g/mol=16g。
=1mol,设氮气的物质的量为xmol,氧气的物质的量为ymol,根据物质的量为1mol,质量为30g可知:x+y=1①,28x+32y=30②,解①②可得y=0.5,则氧气的质量m=nM=0.5mol×32g/mol=16g。

 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案