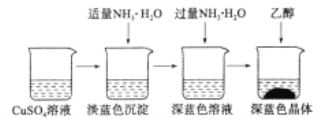
题目内容
【题目】元素及其化合物在生活及生产中有很多重要用途.
Ⅰ.卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物.
(1)拟卤素如(CN)2、(SCN)2、(OCN)2 等与卤素单质结构相似、性质相近.已知(CN)2分子中所有原子都满足 8 电子稳定结构,则其分子中 σ 键与 π 键数目之比为_______.(SCN)2对应的酸有两种,理论上硫氰酸(H﹣S﹣C≡N )的沸点低于异硫氰酸(H﹣N=C=S)的沸点,其原因是_____________.
(2)卤化物 RbICl2 在加热时会分解为晶格能相对较大的卤化物 A 和卤素互化物或卤素单质,A 的化学式_____________.
Ⅱ.SiC、GaN、GaP、GaAs 等是人工合成半导体的材料, 具有高温、高频、大功率和抗辐射的应用性能而成为半导体领域研究热点.试回答下列问题:
(3)碳的基态原子 L 层电子轨道表达式为_______,砷属于_________区元素.
(4)N 与氢元素可形成一种原子个数比为 1:1 的粒子,其式量为 60,经测定该粒子中有一正四面体构型,判断该粒子中存在的化学键_________.
A.配位键 B.极性共价键 C.非极性共价键 D.氢键
(5)CaC2晶体的晶胞结构与 NaCl 晶体的相似(如图1 所示),但 CaC2 晶体中含有的哑铃形 C22﹣的存在,使晶胞沿一个方向拉长. CaC2 晶体中 1 个 Ca2+周围距离最近的 C22﹣数目为________.
Ш. A、B、C 为原子序数依次递增的前四周期的元素,A 的第一电离能介于镁和硫两元素之间,A 单质晶体的晶胞结构如图2 所示. B的价电子排布为(n+1)sn(n+1)pn+2,C位于元素周期表的 ds 区,其基态原子不存在不成对电子. B与 C所形成化合物晶体的晶胞如图3 所示.
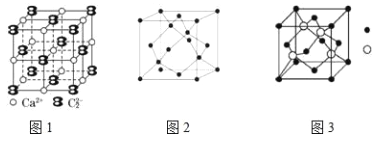
(6)A 单质晶体属于_________晶体(填晶体类型).
(7)B 与 C 所形成化合物晶体的化学式___________.
【答案】 3:4 异硫氰酸分子间可形成氢键,而硫氰酸不能 RbCl  p ABC 4 原子 ZnS
p ABC 4 原子 ZnS
【解析】(1)拟卤素如(CN)2、(SCN)2、(OCN)2 等与卤素单质结构相似、性质相近.已知(CN)2分子中所有原子都满足 8 电子稳定结构,C原子形成四个共价键,原子形成三个共价键,CN)2 结构式为N≡C-C≡N,每个分子中含有3个σ键,4个π键,则其分子中σ键与π键数目之比为3:4;异硫氰酸分子间可形成氢键,而硫氰酸不能形成分子间氢键,能形成分子间氢键的物质分子间作用力大,所以异硫氰酸熔沸点高于硫氰酸。(2)RbICl2加热时会分解为晶格能相对大的卤化物A和卤素互化物或卤素单质,氯离子的半径小于碘离子,RbCl的离子键长小于RbI的离子键长,晶格能较大为RbCl,则A为RbCl;(3)碳原子的L层有4个电子,2个在2S上,2个在2P上,且自旋相同,碳的基态原子L层电子轨道表达式为 ,砷原子的外围电子排布为ns2np5,砷属于P区元素。(4)N 与氢元素可形成一种原子个数比为 1:1 的粒子,其式量为 60,分子式为N2H4,氮原子之间形成非极性键,氮原子和氢原子之间形成极性键,氢原子和氮原子之间形成配位键,故选ABC;(5)根据图知,钙离子的上下、前后、左右有6个C22―,晶胞沿一个方向拉长,CaC2晶体中1个Ca2+周围距离最近的C22-数目为4;(6)A、B、C为原子序数依次递增的前四周期的元素,A的第一电离能介于镁和硫两元素之间,A单质晶体的晶胞结构如图2所示,可知:A为硅形成的晶体,属于原子晶体;
,砷原子的外围电子排布为ns2np5,砷属于P区元素。(4)N 与氢元素可形成一种原子个数比为 1:1 的粒子,其式量为 60,分子式为N2H4,氮原子之间形成非极性键,氮原子和氢原子之间形成极性键,氢原子和氮原子之间形成配位键,故选ABC;(5)根据图知,钙离子的上下、前后、左右有6个C22―,晶胞沿一个方向拉长,CaC2晶体中1个Ca2+周围距离最近的C22-数目为4;(6)A、B、C为原子序数依次递增的前四周期的元素,A的第一电离能介于镁和硫两元素之间,A单质晶体的晶胞结构如图2所示,可知:A为硅形成的晶体,属于原子晶体;
(7)B的价电子排布为(n+1)sn(n+1)pn+2,有三个电子层,外层为6个电子,B为S原子,C位于元素周期表的ds区,其基态原子不存在不成对电子,为Zn原子,B与C所形成化合物晶体的化学式为:ZnS。

 黄冈天天练口算题卡系列答案
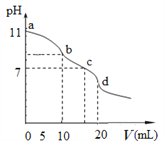
黄冈天天练口算题卡系列答案【题目】30℃时,利用下图装置进行实验,结果记录如下表所示:
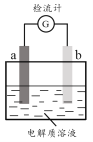
实验 | a电极 | b电极 | 电解质溶液 | 现象 |
I | Cu | Zn | 稀H2SO4 | 检流计指针向左偏转 |
II | Fe | Al | 稀H2SO4 | 检流计指针向左偏转 |
III | Fe | Al | 浓H2SO4 | 检流计指针先向左偏转,后逐渐归零,a电极表面逐渐变黑,b电极表面逐渐变白 |
IV | Fe | Al | 浓HNO3 | 检流计指针迅速向右偏转,a电极逐渐溶解,b电极表面逐渐变白 |
下列说法不正确的是( )
A. II中Al为负极,其电极反应是:Al - 3e- = Al3+
B. III中的现象说明Fe和Al表面形成致密的氧化膜,阻止了电极反应的进行
C. IV中Fe为负极,发生了氧化反应
D. 上述实验表明:相同条件下,Fe在浓HNO3中更稳定,Al在浓H2SO4中更稳定