题目内容
将一定量的Fe和Fe2O3的混合物放入250 mL、1.8 mol·L-1的HNO3溶液中,当固体混合物完全溶解后,在标准状况下生成1.12 L NO(HNO3的还原产物仅此一种),再向反应后的溶液中加入1.0 mol·L-1 NaOH溶液,若要使铁元素完全沉淀,所加入的NaOH溶液的体积最少应为( )
A.300 mL B.400 mL C.450 mL D.500 mL
B
【解析】本题看似复杂,但根据向反应后的溶液中加入NaOH溶液后的溶质只有NaNO3,就可快速解答。根据钠元素和氮元素的对应关系可以求出NaOH的物质的量,n(NaOH)=0.25×1.8-1.12/22.4=0.4 mol。

为研究铜与浓硫酸的反应,某化学兴趣小组进行如下实验。
实验Ⅰ 反应产物的定性探究
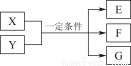
实验装置如图所示。(固定装置已略去)
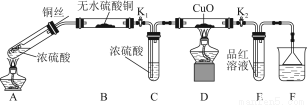
(1)A中反应的化学方程式为 。
(2)F烧杯中的溶液通常是 。
(3)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是 。
(4)实验结束后,证明A装置试管中反应所得产物是否含有铜离子的操作方法是 。
(5)为说明浓硫酸中的水是否影响B装置现象的判断,还须进行一次实验。实验方案为 。
实验Ⅱ 反应产物的定量探究
(6)在铜与浓硫酸反应的过程中,发现有黑色物质出现,经查阅文献获得下列资料。
资料1:
硫酸/mol·L-1 | 黑色物质出现的温度/℃ | 黑色物质消失的温度/℃ |
15 | 约150 | 约236 |
16 | 约140 | 约250 |
18 | 约120 | 不消失 |
资料2:X射线晶体分析表明,铜与浓硫酸反应生成的黑色物质为Cu2S、CuS、Cu7S4中的一种或几种。仅由上述资料可得出的正确结论是 __。
a.铜与浓硫酸反应时所涉及的反应可能不止一个
b.硫酸浓度选择适当,可避免最后产物中出现黑色物质
c.该反应发生的条件之一是硫酸浓度≥15 mol·L-1
d.硫酸浓度越大,黑色物质越快出现、越难消失
(7)为测出硫酸铜的产率,将该反应所得溶液中和后配制成250.00 mL溶液,取该溶液25.00 mL加入足量KI溶液振荡,以淀粉溶液为指示剂,用b mol·L-1Na2S2O3溶液滴定生成的I2,3次实验平均消耗该Na2S2O3溶液V mL。若反应消耗铜的质量为a g,则硫酸铜的产率为 _。(已知:2Cu2++4I-=2CuI+I2,2S2O32-+I2=S4O62-+2I-)
某化学小组在学习元素周期律后,对教材中Fe2+氧化为Fe3+的实验进一步思考,并提出问题:Cl2能将Fe2+氧化为Fe3+,那么Br2和I2能否将Fe2+氧化为Fe3+?
环节一:理论推测
部分同学认为Br2和I2都可能将Fe2+氧化为Fe3+,他们思考的依据是________。
部分同学认为Br2和I2都不能将Fe2+氧化为Fe3+,还有同学认为Br2能将Fe2+氧化为
Fe3+而I2不能。他们思考的依据是从上到下卤素单质氧化性减弱。
环节二:设计实验进行验证
在大试管中加适量铁粉,加入10 mL稀盐酸,振荡试管,充分反应后,铁粉有剩余,取上层清液进行下列实验:。
实验1:
试管 | 操作 | 现象 |
① | 先向试管中加入2 mL FeCl2溶液,再滴加少量红棕色的溴水,振荡试管 | 溶液为黄色 |
② | 先向试管中加入2 mL FeCl2溶液,再滴加少量棕黄色的碘水,振荡试管 | 溶液为黄色 |
环节三:实验现象的分析与解释
(1)同学甲认为①中现象说明溴水能将Fe2+氧化,离子方程式为________。
同学乙认为应该补充实验,才能得出同学甲的结论。请你帮助同学乙完成实验:
实验2:
操作 | 应该观察到的现象 |
(2)该小组同学对②中溶液呈黄色的原因展开了讨论:
可能1:碘水与FeCl2溶液不反应,黄色是碘水稀释后的颜色。
可能2:______________。
实验3:进行实验以确定可能的原因。
操作 | 现象 |
向试管②所得溶液中继续加入0.5 mL CCl4,充分振荡,静置一段时间后。取出上层溶液,滴KSCN溶液 | 静置后,上层溶液几乎无色,下层溶液为紫色;上层溶液滴加KSCN溶液后,出现浅红色 |
同学丙认为该实验现象可以说明是“可能2”成立,同学丁认为不严谨,于是设计了实验4:
实验4:
操作 | 现象 |
向另一支试管中加入2 mL FeCl2溶液,滴加0.5 mL碘水后,再加入0.5 mL乙酸乙酯,充分振荡,静置一段时间后。取出下层溶液,滴加KSCN溶液 | 静置后,上层溶液为紫色,下层溶液几乎无色;下层溶液滴加KSCN溶液后,没有出现浅红色 |
你认为实验4设计的主要目的是________________。
同学丁根据实验4现象得出结论:在本次实验条件下,碘水与FeCl2溶液反应的程度很小。
(3)Cl2、Br2、I2氧化Fe2+的能力逐渐减弱,用原子结构解释原因:__________。