题目内容
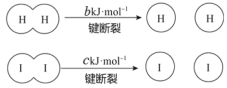
【题目】氨的合成对国家工业发展有着举足轻重的作用,N2(g)+3H2(g) ![]() 2NH3(g) △H<0(图中T表示温度,n表示物质的量),下列说法不正确的是
2NH3(g) △H<0(图中T表示温度,n表示物质的量),下列说法不正确的是
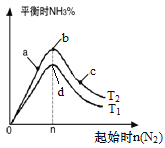
A.图中T2和T1的关系是:T2<T1
B.在a、b、c三点所处的平衡状态中,反应物H2的转化率最高的是b
C.在起始体系中n(N2):n(H2)=1:3时,反应后氨的百分含量最大
D.反应体系中活化分子的百分含量d>b
【答案】B
【解析】
A. N2(g)+3H2(g) ![]() 2NH3(g) △H<0,为放热反应,升高温度,反应逆向移动,氨气的百分含量减小,则图中 T2和 T1的关系是: T2<T1,故A正确;
2NH3(g) △H<0,为放热反应,升高温度,反应逆向移动,氨气的百分含量减小,则图中 T2和 T1的关系是: T2<T1,故A正确;
B. 在a、b、c三点所处的平衡状态中,c点反应物 N2的物质的量比a、b点大,反应正向移动,氢气的转化率最高,故B错误;
C. 根据反应物的物质的量之比等于化学计量数之比时,达到平衡状态时生成物的百分含量最大,在起始体系中n(N2):n(H2)=1:3时,反应后氨的百分含量最大,故C正确;
D. b和d点氮气的起始物质的量相同,平衡时b点氨气的百分含量比d点大, 由于T2<T1,温度越高,活化分子的百分数越高,则反应体系中活化分子的百分含量d>b,故D正确;
答案选B。

 智慧小复习系列答案
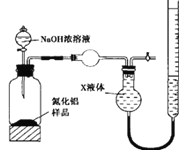
智慧小复习系列答案【题目】SO2是一种大气污染物,某兴趣小组欲探究SO2的性质及绿色实验方法,设计如下方案:
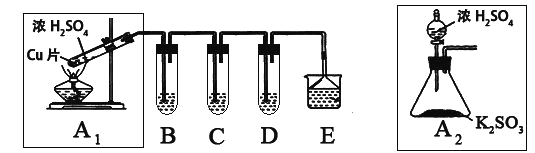
⑴ B、C、D分别用于检验SO2的漂白性、还原性和氧化性。其中C、D分别为碘水和硫化氢的水溶液,则B中所盛试剂为______________,C中反应的离子方程式为:____________________________________________。
⑵为了实现绿色实验的目标,某同学重新设计了如上右图A2的制取装置来代替A1装置,与A1装置相比,A2装置的优点是:____________________________________________________(任写一点即可)。
⑶ E中用氨水吸收尾气中的SO2,“吸收液”中可能含有OH-、SO32-、SO42-、HSO3-等阴离子。已知亚硫酸氢盐一般易溶于水,SO2也易溶于水。现有仪器和试剂为:小烧杯、试管、玻璃棒、胶头滴管、过滤装置和滤纸;2mol/L盐酸、2mol/L HNO3、1mol/L BaCl2溶液、1mol/L Ba(OH)2溶液、品红溶液、蒸馏水。请设计实验证明“吸收液”中存在SO32-和HSO3-,完成下表的实验操作、预期现象和结论:
实验操作 | 预期现象与结论 |
步骤1:取适量“吸收液”于小烧杯中,用胶头滴管取1mol/L BaCl2溶液向小烧杯滴加直至过量。 | 若出现白色浑浊,则溶液中存在SO32-或 SO42-。 |
步骤2:将小烧杯中的浊液过滤、洗涤,再用适量水把附在滤纸上的固体冲入另一小烧杯中;向冲下的固体________________________________________________________________ | _____________________ |
步骤3____________________________________________ | _________________________ |