题目内容
【题目】M、N、O、P、Q是元素周期表中原子序数依次递增的前四周期元素.M原子最外层电子数为内层电子数的3倍;N的焰色反应呈黄色;O的氢化物是一种强酸,其浓溶液可与M、Q的化合物反应生成O的单质;P是一种金属元素,其基态原子中有6个未成对电子.请回答下列问题:
(1)元素Q的名称为______________,P的基态原子价层电子排布式为__________________。
(2)O的氢化物的沸点比其上一周期同族元素的氢化物低,是因为___________________。
(3)M、O电负性大小顺序是__________(用元素符号表示),实验室制备O单质的化学方程式__________________________。
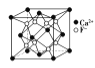
(4)M、N形成的化合物的晶胞如图所示,该晶胞的边长为 a pm,则该晶体的密度为____________________g/cm3

【答案】锰 3d54s1 HF分子间存在氢键,而HCl分子间无氢键 O>Cl 4HCl(浓)+MnO2![]() Cl2↑+MnCl2+2H2O
Cl2↑+MnCl2+2H2O ![]()
【解析】
依题意可知:M为氧元素,N为钠元素,O是氯元素,P是铬元素,Q是锰元素,因此有:
(1)元素Q的名称为锰,P的基态原子价层电子排布式为3d54s1;
(2)O的氢化物的沸点比其上一周期同族元素的氢化物低是因为HF分子间存在氢键,而HCl分子间无氢键;
(3)M、O电负性大小顺序是O>Cl,实验室利用二氧化锰与浓盐酸共热制取氯气,反应的化学方程式为4HCl(浓)+MnO2![]() Cl2↑+MnCl2+2H2O;
Cl2↑+MnCl2+2H2O;
(4)M、N分别为氧元素和钠元素,根据晶胞结构示意图可知,一个晶胞含有个8![]() 氧原子,8个钠原子,其化学式为Na2O,该晶胞的边长为 a pm,则该晶体的密度为
氧原子,8个钠原子,其化学式为Na2O,该晶胞的边长为 a pm,则该晶体的密度为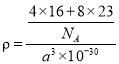 =
=![]() g/cm3。
g/cm3。

练习册系列答案
相关题目