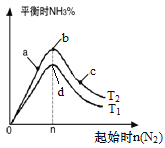
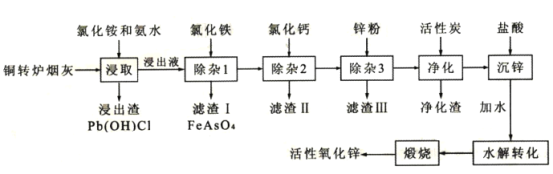
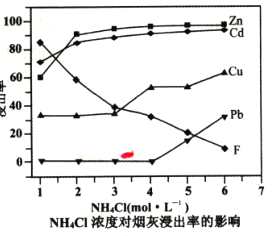
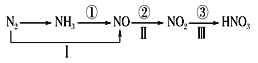
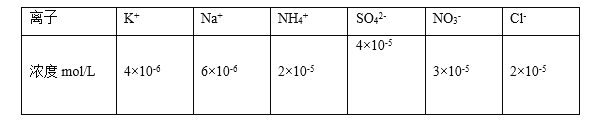
题目内容
【题目】下列各组离子在指定环境中一定能大量共存的是( )
A.使pH试纸显蓝色的溶液中:Cu2+、NO![]() 、Fe3+、SO
、Fe3+、SO![]()
B.与铝粉反应放出氢气的无色溶液中:NO![]() 、Al3+、Na+、SO
、Al3+、Na+、SO![]()
C.pH=0的溶液中:Al3+、NH![]() 、Ca2+、ClO-
、Ca2+、ClO-
D.使红色石蕊试纸变蓝的溶液中:SO![]() 、CO
、CO![]() 、Na+、K+
、Na+、K+
【答案】D
【解析】
A.使pH试纸显蓝色的溶液呈碱性,存在大量氢氧根离子,Cu2+、Fe3+与氢氧根离子反应,在溶液中不能大量共存,故A错误;
B.与铝粉反应放出氢气的无色溶液呈酸性或强碱性,NO3-在酸性条件下具有强氧化性,与Al反应不会生成氢气;Al3+与氢氧根离子反应,在溶液中不能大量共存,故B错误;
C.pH=0的溶液中存在大量氢离子,Al3+、H+都与ClO-反应,在溶液中不能大量共存,故C错误;
D.使红色石蕊试纸变蓝的溶液呈碱性,存在大量氢氧根离子,SO32-、CO32-、Na+、K+之间不反应,也都不与氢氧根离子反应,在溶液中能够大量共存,故D正确;
答案为D。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目