题目内容
【题目】氮化铝(AlN)是一种新型无机非金属材料。某AlN样品仅含有Al2O3杂质,为测定AlN的含量,设计如下三种实验方案。(已知:AlN+NaOH+H2O=NaAlO2+NH3↑)
(方案l)取一定量的样品,用以下装置测定样品中AlN的纯度(夹持装置已略去)。

(1)图中球形干燥管的作用是__________________。
(2)完成以下实验步骤:组装好实验装置,检查装置气密性,再加入实验药品。接下来的实验操作是: 关闭K1,打开K2,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体。然后打开K1,通入氮气一段时间,测定C装置反应前后的质量变化。通入氮气的目的是_____________。
(3)假设其他操作均正确,按照图装置将导致测定结果_______________(填“偏高”、“偏低”或“无影响”)。
(方案2)用图装置测定m g样品中AlN的纯度(部分夹持装置已略去)。
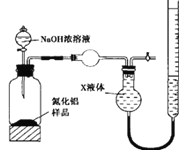
(4)为测定生成气体的体积,量气装置中的X液体最好选择________________。
a.CCl4 b.H2O c.饱和NH4Cl溶液 d.浓硫酸
(5)若m g样品完全反应,测得生成气体的体积为V mL(已转换为标准状况)。则AlN的质量分数是___________________(需化简)。
(方案3)按下列路径测定样品中AlN的纯度:

(6)写出步骤反应的离子方程式_____________________。
(7)该方案能否测出AlN的纯度?(若能请用m1,m2列出计算纯度的表达式)__________。
【答案】(1)防倒吸 (2)把装置中残留的氨气全部排入C装置中 (3)偏高 (4)a (5)41V/22400m (6)AlN+OH-+H2O=AlO2-+NH3↑ Al2O3+2OH-=AlO2-+H2O (7)41(m2-m1)/10m1
【解析】
试题(1)氨气是与浓硫酸能发生反应的气体,容易发生倒吸,图C装置中球形干燥管的作用是防倒吸。(2)通入氮气的目的是把装置中残留的反应生成的氨气全部排入C装置中被浓硫酸吸收,准确测定装置C的增重。(3)图1中空气中的水蒸气和二氧化碳进入装置C,使的定结果偏高。(4)a、四氯化碳不能溶解氨气,可以用排四氯化碳溶液的方法收集氨气并测定体积,正确;b、氨气极易溶于水,不能用排水法测定,错误;c、氨气极易溶于水,不能用氯化铵溶液,错误;d、氨气能和浓硫酸反应,错误。所以选a。 (5)根据氮原子守恒,氨气的物质的量就是氮化铝的物质的量,则氮化铝的物质的量为V/22400mol,则氮化铝的质量分数为![]() =41V/22400m(6)从流程分析,氮化铝和氢氧化钠反应生成偏铝酸钠和氨气,离子方程式为:AlN+OH-+H2O=AlO2-+NH3↑ ;氧化铝和氢氧化钠反应生成偏铝酸钠和水,离子方程式为: Al2O3+2OH-=AlO2-+H2O(7)根据反应分析,氮化铝和氧化铝最后都为氧化铝,所以固体增重就为氮化铝变氧化铝造成的,所以根据质量差值计算
=41V/22400m(6)从流程分析,氮化铝和氢氧化钠反应生成偏铝酸钠和氨气,离子方程式为:AlN+OH-+H2O=AlO2-+NH3↑ ;氧化铝和氢氧化钠反应生成偏铝酸钠和水,离子方程式为: Al2O3+2OH-=AlO2-+H2O(7)根据反应分析,氮化铝和氧化铝最后都为氧化铝,所以固体增重就为氮化铝变氧化铝造成的,所以根据质量差值计算
2AlN ~ Al2O3 质量改变20
41×2 (m2-m1)
则氮化铝的质量为41(m2-m1)/10,则氮化铝的质量分数为 41(m2-m1)/10m1

【题目】(I)俄美科学家联合小组宣布合成出114号元素(FI)的一种同位素,该原子的质量数是289,试回答下列问题:
(1)该元素在周期表中的位置______________,属于金属元素还是非金属元素?____
(2)如果该元素存在最高价氧化物对应的水化物,请写出其化学式___________________。
(II)下表为元素周期表的部分,列出了10种元素在元素周期表中的位置,试回答下列问题:

(1)元素⑦的氢化物与⑧的单质反应的离子方程式为__________。
(2)元素②和⑤的最高价氧化物的水化物相互反应的化学方程式为___________。
(3)元素Fe的单质与⑦的氢化物高温下反应的化学方程式为___________。
(III)判断以下叙述正确的是__________。
部分短周期元素的原子半径及主要化合价
元素代号 | L | M | Q | R | T |
原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
A.L2+、R2-的核外电子数相等
B.单质与稀盐酸反应的速率L<Q
C.M与T形成的化合物一定具有两性
D.氢化物的沸点为HnT>HnR
E. M的单质能与盐酸、NaOH溶液反应放出氢气