题目内容
13.恒压在一个可变容积的密闭容器中发生:2NH3(g)+CO2(g)?CO(NH2)2(g)+H2O(g)若开始时放入2mol NH3和1mol CO2,达平衡后,生成a mol H2O;若开始时放入x molNH3、2mol CO2和1mol H2O(g)和1mol CO(NH2)2(g),达平衡后,H2O的物质的量是3a mol,则x为4.分析 第二次平衡时氨气的物质的量是第一次平衡时氨气物质的量的3倍,则全部转化为反应物时,其物质的量也应该是第一次加入的物质的量的3倍,利用极限法把生成物转化为反应物据此计算.
解答 解:若开始时放入2mol NH3和1mol CO2,达平衡后,生成a mol H2O;
若开始时放入x molNH3、2mol CO2和1mol H2O(g)和1mol CO(NH2)2(g),达平衡后,H2O的物质的量是3a mol,
把CO(NH2)2(g)和H2O(g)转化为反应物,则NH3的物质的量为x+2mol,则$\frac{2mol}{(x+2)mol}$=$\frac{a}{3a}$,解得x=4;
故答案为:4.
点评 本题考查了化学平衡的有关计算,侧重于考查等效平衡的原理以及等效平衡在计算中的应用,题目难度不大,注意把握等效平衡的实质.

练习册系列答案
相关题目
3.下列说法中正确的是( )
| A. | 淀粉和蛋白质水解的最终产物都只有一种 | |
| B. | 蔗糖和淀粉都不能发生氧化反应 | |
| C. | 棉花、合成纤维、ABS树脂、蚕丝和核酸都属于高分子化合物 | |
| D. | 石油裂解和油脂皂化都是由高分子生成小分子的过程 |
4.下列描述正确的是( )
| A. | 氯气、SO2都能使品红溶液褪色,它们的漂白原理相同 | |
| B. | 滴加石蕊试液显红色的溶液:Fe3+、NH4+、I-可能大量共存 | |
| C. | 某溶液中加入盐酸酸化的氯化钡产生白色沉淀,原溶液中一定含有SO42- | |
| D. | Fe(NO3)2溶液中滴加少量稀硫酸会变黄色 |
1.为更好地表示溶液的酸碱性,科学家提出了酸度(AG)的概念,AG=lg$\frac{c({H}^{+})}{c(O{H}^{-})}$,则下列叙述正确的是( )
| A. | 中性溶液的 AG=0 | B. | 酸性溶液的AG<0 | ||
| C. | 常温下0.1mol/LNaOH溶液的AG=12 | D. | 常温下0.1mol/L盐酸溶液的AG=12 |
8.向1L某FeBr2溶液中,通入1.12L(标准状况下)的Cl2,测得溶液中c(Br-)=3c(Cl-)=0.3mol/L.反应过程中溶液的体积变化忽略不计,则下列说法中正确的是( )
| A. | 原溶液的浓度约为0.13mol/L | B. | 反应后溶液中c(Fe3+)=0.1mol/L | ||
| C. | 反应后溶液中c(Fe3+)=c(Fe2+) | D. | 原溶液中c(Br-)=0.4mol/L |
18.现有T、X、Y、W、M原子序数依次增大的短周期元素,常温、常压下,Y有两种常见的气态单质,其中一种成为环境监测新增标准,T、Y与X相邻,W的所有盐都易溶于水且日常生活中存在W的盐,M的氢氧化物在水中存在两种电离方式.加入酸或碱,都能使电离平衡发生移动,下列有关说法正确的是( )
| A. | T、W、M的最高价氧化物的水化物相互反应 | |
| B. | T、Y、W组成的化合物溶于含酚酞的水,溶液显红色 | |
| C. | 简单离子半径:r(W)>r(M)>r(Y)>r(X) | |
| D. | 简单氢化物的稳定性:X>T>Y |
5.将一定浓度的碘酸钾溶液和亚硫酸氢钠溶液混合,发生反应:2KIO3+6NaHSO3═2KI+3Na2SO4+3H2SO4.实验发现:开始反应缓慢,随后反应速率“急增”,最后又逐渐减小.下列有关化学反应速率“急增”的解释合理的是( )
| A. | c(IO3-)、c(HSO3-)逐渐增大 | B. | c(K+)逐渐增大,反应速率加快 | ||
| C. | 溶液的pH减小,IO3-的氧化性增强 | D. | c(H+)增大,反应速率加快 |
3.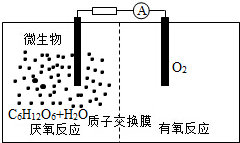 微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示.下列有关微生物电池的说法错误的是( )
微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示.下列有关微生物电池的说法错误的是( )
 微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示.下列有关微生物电池的说法错误的是( )
微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示.下列有关微生物电池的说法错误的是( )| A. | 正极反应中有CO2生成 | |
| B. | 微生物促进了反应中电子的转移 | |
| C. | 质子通过交换膜从负极区移向正极区 | |
| D. | 电池总反应为C6H12O6+6O2═6CO2+6H2O |